O estado de qualquer substância gasosa é determinado pela medida de três grandezas: o volume (V), a pressão (P) e a temperatura (T ) dessa substância. Para os chamados gases “ideais”, o valor do quociente P.V/T é sempre constante. Considere um reservatório que está cheio de um gás ideal. Sem vazar o gás, realiza-se uma compressão do reservatório, reduzindo seu volume à metade. Ao mesmo tempo, uma fonte de calor faz a temperatura do gás ser quadruplicada. Considere P0 e P1 respectivamente, os valores da pressão do gás no reservatório, antes e depois do procedimento descrito.
A relação entre P0 e P1 é
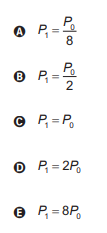
Resolução
Temos que
P0.V0/T0 = P1.V1/T1
Se V1 = V0/2 e T1 = 4T0 temos que
P0.V0/T0 = P1V0/(2.4T0)
P0.V0/T0 = P1.V0/8T0
Dividindo os dois lados por V0 e multiplicando por T0, temos
P0 = P1/8
P1 = 8P0
Alternativa E






