Um assistente de laboratório precisou descartar sete frascos contendo solução de nitrato de mercúrio (I) que não foram utilizados em uma aula prática. Cada frasco continha 5,25 g de Hg2(NO3)2 dissolvidos em água. Temendo a toxidez do mercúrio e sabendo que o Hg2Cl2 tem solubilidade muito baixa, o assistente optou por retirar o mercúrio da solução por precipitação com cloreto de sódio (NaCl), conforme a equação química:
Na dúvida sobre a massa de NaCl a ser utilizada, o assistente aumentou gradativamente a quantidade adicionada em cada frasco, como apresentado no quadro.
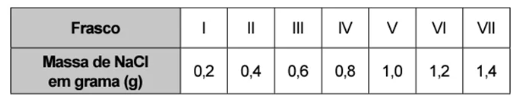
O produto obtido em cada experimento foi filtrado, secado e teve sua massa aferida. O assistente organizou os resultados na forma de um gráfico que correlaciona a massa de NaCl adicionada com a massa de Hg2Cl2 obtida em cada frasco. A massa molar do Hg2(NO3)2 é 525 g mol–1, a do NaCl é 58 g mol–1 e a do Hg2Cl2 é 472 g mol–1.
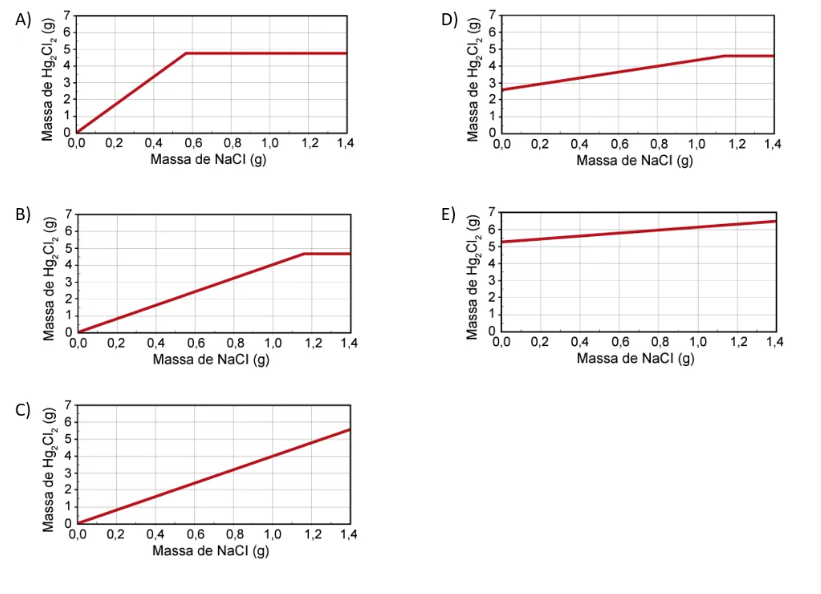
Qual foi o gráfico obtido pelo assistente de laboratório?
Solução
O exercício fornece a massa dos reagentes e também a equação química balanceada. A partir disso é possível calcular qual a quantidade necessária de NaCl para reagir completamente com os 5,25 g de Hg2(NO3)2:
1 mol de Hg2(NO3)2 2 mol de NaCl
525 g ——————————– 116 g
5,25 g ——————————- X
X = 1,16 g de NaCl
O valor de X encontrado é a massa de NaCl que reagirá completamente com os 5,25 g de Hg2(NO3)2. Isso significa que qualquer valor acima de 1,16 g para a massa de NaCl resultará em um excesso do cloreto de sódio (NaCl).
O gráfico obtido pelo assistente do laboratório deve:
– Partir da origem, já que sem massa NaCl não ocorre reação e, portanto, não haverá formação Hg2Cl2
– Ter massa de Hg2Cl2 constante a partir dos frascos VI e VII. Devemos considerar que qualquer valor acima de 1,16 g de NaCl resultará em um excesso do reagente e não haverá mais formação do produto, uma vez que toda a massa de Hg2(NO3)2 terá sido consumida.
Caso seja necessário, também é possível calcular massa máxima de Hg2Cl2 formada:
1 mol de Hg2(NO3)2 1 mol de Hg2Cl2
525 g ——————————– 472 g
5,25 g ——————————- m g
m = 4,72 g de Hg2Cl2 (valor máximo do eixo Y)
A partir do que foi calculado e analisado, o gráfico obtido será o da alternativa B.
Alternativa B






