Os combustíveis são materiais utilizados na produção de energia que, dependendo da sua composição, podem produzir diferentes substâncias. Por exemplo, numa queima completa, o hidrogênio se transforma em H2O; e o carbono, em CO2.
O quadro apresenta as entalpias de combustão de alguns combustíveis nas condições padrão.
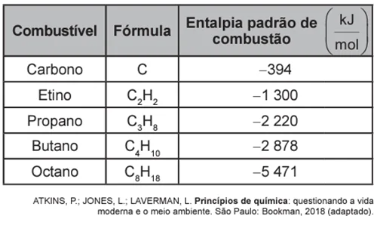
Visando a redução do impacto ambiental, qual dos combustíveis listados libera maior quantidade de energia com menor produção de CO2?
A) Carbono.
B) Etino.
C) Propano.
D) Butano.
E) Octano.
Solução
O objetivo é produzir a maior quantidade de energia a partir da menor quantidade de CO2. Para realizarmos o cálculo, podemos fixar a quantidade de CO2 produzida em 1 mol.
Foi mencionado no enunciado que na combustão completa o hidrogênio origina a água e o carbono forma o CO2. Portanto, o número de mol de CO2 que cada combustível produz depende diretamente da quantidade de carbono existente na estrutura do próprio combustível (balanceamento). Logo, podemos considerar que:
– Se no C existe somente um carbono na estrutura, teremos apenas 1 mol de CO2 formado nos produtos. Como fixamos a quantidade em exatamente 1 mol, o carbono como combustível vai liberar 394 kJ/mol de energia.
– No caso do etino (C2H2), existem 2 carbonos na estrutura, formando, portanto, 2 mol de CO2 nos produtos. Para calcularmos a energia liberada por mol de CO2, basta dividir o valor da entalpia padrão de combustão por 2, o que resulta na liberação de 650 kJ/mol de energia.
– Para o propano (C3H8), que apresenta 3 carbonos na estrutura, serão formados, 3 mol de CO2 nos produtos. Após o cálculo da energia liberada para 1 mol de CO2, encontramos o valor de 740 kJ/mol (valor da entalpia padrão de combustão dividido por 3)
– Realizando o mesmo raciocínio dos casos anteriores, o butano irá liberar uma energia de 719,5 kJ/mol e o octano 683,8 kJ/mol.
Portanto, o combustível que libera uma maior quantidade de energia com menor produção de CO2 é o propano.
Alternativa C






