Os tanques de armazenamento de gasolina podem, com o tempo, sofrer processos oxidativos, resultando na contaminação do combustível e do solo à sua volta. Uma forma de evitar tais problemas econômicos e ambientais é utilizar preferencialmente metais de sacrifício, protegendo os tanques de armazenamento.
Suponha que seja necessário usar um metal de sacrifício em um tanque de aço (liga de ferro-carbono). Considere as semirreações de redução e seus respectivos potenciais padrão.
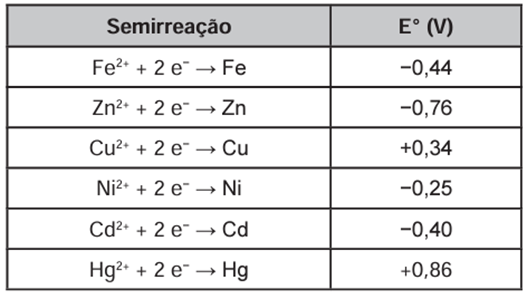
Dos metais citados, o que garantirá proteção ao tanque de aço é o
A) zinco.
B) cobre.
C) níquel.
D) cádmio.
E) mercúrio.
Solução
Para proteger o tanque de aço, o metal escolhido precisa sofrer oxidação no lugar do ferro (presente na composição do aço). Um metal que oxida para proteger outro é chamado de metal de sacrifício, e é necessário que ele apresente um maior potencial de oxidação em relação ao metal que será protegido.
Quanto maior o potencial de oxidação, maior a tendência de o metal ser oxidado. Espécies com maiores potenciais de oxidação apresentam, simultaneamente, menores potenciais de redução (fornecidos pelo enunciado).
Assim, em relação ao ferro, somente o zinco será capaz de protegê-lo, pois é o único que possui um menor potencial de redução ou um maior potencial de oxidação.
Alternativa A






