Glicólise é um processo que ocorre nas células, convertendo glicose em piruvato. Durante a prática de exercícios físicos que demandam grande quantidade de esforço, a glicose é completamente oxidada na presença de O2. Entretanto, em alguns casos, as células musculares podem sofrer um déficit de O2 e a glicose ser convertida em duas moléculas de ácido lático. As equações termoquímicas para a combustão da glicose e do ácido lático são, respectivamente, mostradas a seguir:
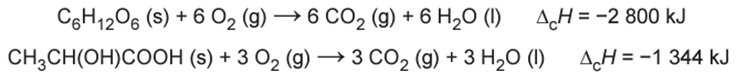
O processo anaeróbico é menos vantajoso energeticamente porque
A) libera 112 kJ por mol de glicose.
B) libera 467 kJ por mol de glicose.
C) libera 2 688 kJ por mol de glicose.
D) absorve 1 344 kJ por mol de glicose.
E) absorve 2 800 kJ por mol de glicose.
Solução
Foi dito no enunciado que a glicose pode ser convertida em duas moléculas de ácido lático. Portanto, devemos considerar a seguinte equação global:
C6H12O6 (s) → 2 CH3CH(OH)COOH (s)
A partir das duas reações de combustão fornecidas, podemos calcular o ΔH da equação global utilizando a Lei de Hess. Isso nos permitirá entender por que o processo anaeróbico é menos vantajoso energeticamente.
Seguindo a Lei de Hess, devemos manter a primeira equação como fornecida. Para a segunda equação, devemos invertê-la e depois multiplicá-la por 2 (todas as modificações feitas nas equações também devem ser feitas nos valores de ΔH). Dessa forma, temos que:
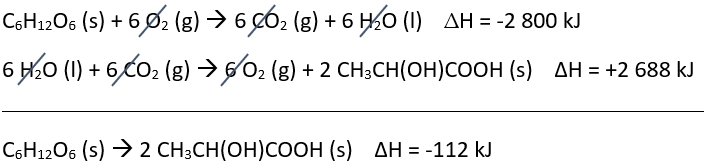
Conforme indica a soma das duas equações e consequentemente dos valores de ΔH, o processo anaeróbico é menos vantajoso energeticamente porque libera 112 kJ por mol de glicose.
Alternativa A






