Laboratórios de química geram como subprodutos substâncias ou misturas que, quando não têm mais utilidade nesses locais, são consideradas resíduos químicos. Para o descarte na rede de esgoto, o resíduo deve ser neutro, livre de solventes inflamáveis e elementos tóxicos como Pb, Cr e Hg. Uma possibilidade é fazer uma mistura de dois resíduos para obter um material que apresente as características necessárias para o descarte. Considere que um laboratório disponha de frascos de volumes iguais cheios dos resíduos, listados no quadro.
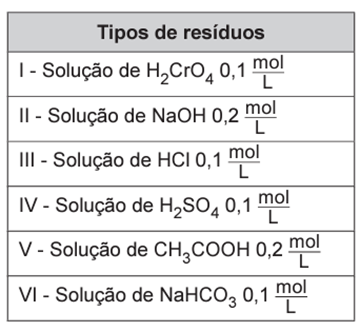
Qual combinação de resíduos poderá ser descartada na rede de esgotos?
A) I e II
B) II e III
C) II e IV
D) V e VI
E) IV e VI
Solução
De acordo com o enunciado, para o descarte na rede de esgoto, o resíduo deve ser neutro, livre de solventes inflamáveis e sem elementos tóxicos como Pb, Cr e Hg.
Analisando as alternativas fornecidas:
1. Mistura de Volumes Iguais de I e II: A mistura de volumes iguais de ácido crômico (CrO₃) e hidróxido de sódio (NaOH) resulta na formação de água e um sal contendo cromo (Cr), o que o torna inadequado para descarte direto devido à toxicidade do cromo.
2. Mistura de Volumes Iguais de II e III: Quando se misturam volumes iguais de hidróxido de sódio (NaOH) e ácido clorídrico (HCl), ocorre uma reação de neutralização. No entanto, como a concentração de NaOH é maior do que a de HCl e a estequiometria da reação requer uma proporção de 1:1, o resultado será um meio com excesso de base. Portanto, o pH final da solução será básico e não neutro.
3. Mistura de Volumes Iguais de II e IV: A mistura de volumes iguais de hidróxido de sódio (NaOH) e ácido sulfúrico (H₂SO₄) resulta em uma reação de neutralização que segue a proporção estequiométrica de 2 mols de base para cada 1 mol de ácido. Considerando que as concentrações são adequadas para essa proporção, a solução final será neutra, sem solventes inflamáveis ou elementos tóxicos presentes nos produtos.
4. Mistura de Volumes Iguais de V e VI: Quando se misturam volumes iguais de ácido acético (CH₃COOH) e bicarbonato de sódio (NaHCO₃), ocorre uma reação ácido-base. No entanto, devido às concentrações diferentes das soluções e à proporção estequiométrica de 1:1, o meio não se tornará neutro. A solução final será levemente ácida, já que o ácido está em excesso.
5. Mistura de Volumes Iguais de IV e VI: A mistura de volumes iguais de ácido sulfúrico (H₂SO₄) e bicarbonato de sódio (NaHCO₃) resultará em uma solução com excesso de ácido. A reação entre esses reagentes ocorre na proporção de 2 mols de bicarbonato para 1 mol de ácido sulfúrico. Como as concentrações das soluções são iguais, haverá uma neutralização parcial, e a solução final terá pH ácido devido ao excesso de ácido sulfúrico.
Alternativa C






