O gás hidrogênio é considerado um ótimo combustível — o único produto da combustão desse gás é o vapor de água, como mostrado na equação química.
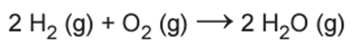
Um cilindro contém 1 kg de hidrogênio e todo esse gás foi queimado. Nessa reação, são rompidas e formadas ligações químicas que envolvem as energias listadas no quadro.
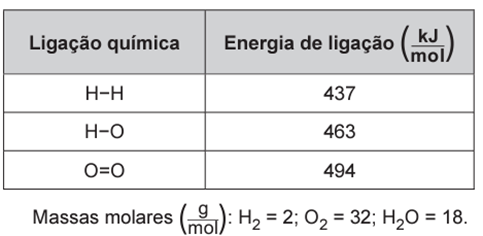
Qual é a variação da entalpia, em quilojoule, da reação de combustão do hidrogênio contido no cilindro?
A) −242 000
B) −121 000
C) −2 500
D) +110 500
E) +234 000
Solução
A variação da entalpia de uma reação pode ser calculada a partir das energias de ligação. Para isso, devemos considerar todas as ligações existentes entre os átomos e também a relação estequiométrica:
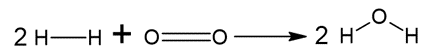
REAGENTES:
As ligações estão sendo rompidas. Portando, o somatório da energia envolvida será positivo, já que o processo é endotérmico.
Pelo balanceamento, temos 2 mol de H2 e cada molécula de H2 realiza uma ligação H – H. Logo: 2 mol x 437 kJ/mol = 874 kJ
Pelo balanceamento, temos 1 mol de O2 e cada molécula de O2 realiza uma ligação O = O. Sendo assim, temos: 1 mol x 494 kJ/mol = 494 kJ
Somando as energias das ligações dos reagentes: 1368 kJ
PRODUTOS:
As ligações estão sendo formadas. Portando, o somatório da energia envolvida será considerado negativo, já que o processo é exotérmico.
Pelo balanceamento, temos 2 mol de H2O e cada molécula de H2O realiza duas ligações O – H. Logo: 2 mol x 2 x 463 kJ/mol = 1852 kJ, que deve ser considerado – 1852 kJ.
A variação da entalpia é dada pelo somatório dos valores encontrados para reagentes e produtos:
ΔH = Hreagentes + Hprodutos
ΔH = 1368 kJ + (- 1852 kJ) = – 484 kJ.
Isso significa que para a reação em questão, o ΔH de combustão é de – 484 kJ.
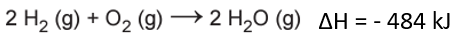
Por fim, para calcularmos a variação da entalpia de combustão do gás hidrogênio contido no cilindro (1 kg de H2), precisamos estabelecer uma simples relação por regra de três.
2 mol de H2 (4 g), liberam 484 kJ de energia, 1 kg (1000 g) irá liberar:
H2 ENERGIA
4 g ————— 484 kJ
1000 g ———- x
x = 121 000 kJ
Alternativa B






