Por meio de reações químicas que envolvem carboidratos, lipídeos e proteínas, nossas células obtêm energia e produzem gás carbônico e água. A oxidação da glicose no organismo humano libera energia, conforme ilustra a equação química, sendo que aproximadamente 40% dela é disponibilizada para atividade muscular.
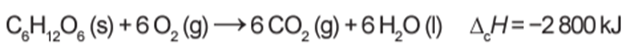
Considere as massas molares (em g mol−1): H = 1; C = 12; O = 16.
LIMA, L. M.; FRAGA, C. A. M.; BARREIRO, E. J. Química na saúde.
São Paulo: Sociedade Brasileira de Química, 2010 (adaptado).
Na oxidação de 1,0 grama de glicose, a energia obtida para atividade muscular, em quilojoule, é mais próxima de
A) 6,2.
B) 15,6.
C) 70,0.
D) 622,2.
E) 1 120,0.
Solução
A equação balanceada nos mostra que 1 mol de glicose libera 2800 kJ de energia. A partir dessa informação é possível calcular qual a energia liberada na oxidação de 1 g da glicose. Sabendo que a massa molar (de 1 mol) de C6H12O6 é igual a 180 g, temos que:
MASSA ENERGIA LIBERADA
180 g ———- 2800 kJ
1 g ————- x
x = 15,55 kJ
Entretanto, apenas 40% do valor encontrado é obtido para a atividade muscular:
ENERGIA PORCENTAGEM
15,55 kJ ——- 100%
y —————– 40%
y = 6,22 kJ de energia disponibilizada para atividade muscular.
Alternativa A






