Objetos de prata sofrem escurecimento devido à sua reação com enxofre. Estes materiais recuperam seu brilho característico quando envoltos por papel alumínio e mergulhados em um recipiente contendo água quente e sal de cozinha.
A reação não balanceada que ocorre é:
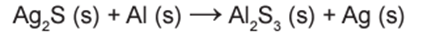
Dados da massa molar dos elementos (g mol−1): Ag = 108; S = 32.
UCKO, D. A. Química para as ciências da saúde: uma introdução à química geral,
orgânica e biológica. São Paulo: Manole, 1995 (adaptado).
Utilizando o processo descrito, a massa de prata metálica que será regenerada na superfície de um objeto que contém 2,48 g de Ag2S é
A) 0,54 g.
B) 1,08 g.
C) 1,91 g.
D) 2,16 g.
E) 3,82 g.
Solução
A reação balanceada é dada por:
3 Ag2S (s) + 2 Al (s) à Al2S3 (s) + 6 Ag (s)
Considerando as massas molares e também que 3 mol de Ag2S formam 6 mol de prata metálica, podemos estabelecer a seguinte relação:
– 1 mol de Ag2S = 248 g/mol
– 1 mol de Ag = 108 g/mol
3 mol de Ag2S 6 mol de Ag
744 g ———————— 648 g
2,48 g ———————– x
x = 2,16 g de prata metálica podem ser recuperados a partir de 2,48 g de Ag2S.
Alternativa D






