O aproveitamento integral e racional das matérias-primas lignocelulósicas poderá revolucionar uma série de segmentos industriais, tais como o de combustíveis, mediante a produção de bioetanol de segunda geração. Este processo requer um tratamento prévio da biomassa, destacando-se o uso de ácidos minerais diluídos. No pré-tratamento de material lignocelulósico por via ácida, empregou-se uma solução de ácido sulfúrico, que foi preparada diluindo-se 2 000 vezes uma solução de ácido sulfúrico, de concentração igual a 98 g/L , ocorrendo dissociação total do ácido na solução diluída. O quadro apresenta os valores aproximados de logaritmos decimais
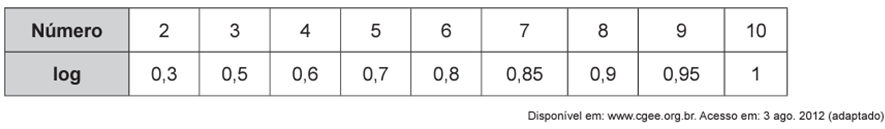
Sabendo-se que as massas molares, em g/mol, dos elementos H, O e S são, respectivamente, iguais a 1, 16 e 32, qual é o pH da solução diluída de ácido sulfúrico preparada conforme descrito?
A) 2,6
B) 3,0
C) 3,2
D) 3,3
E) 3,6
Solução
Primeiro, vamos encontrar a concentração da solução diluída e, em seguida, calcular o pH.
Dados:
– Concentração da solução original de ácido sulfúrico: 98 g/L
– Fator de diluição: 2000 vezes.
A concentração de 98 g/L equivale a concentração molar de 1 mol/L, já que a massa molar do ácido sulfúrico é igual a 98 g/mol. Considerando que a solução foi diluída 2000 vezes, a nova concentração da solução diluída é dada por:
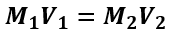
em que:
M1 = concentração molar inicial = 1 mol/L
V1 = volume inicial = V
M2 = concentração molar final
V2 = 2000V
Ao substituir os valores, temos:
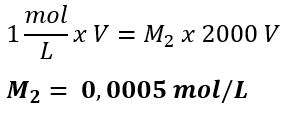
Determinação do pH
O ácido sulfúrico (H2SO4) é um ácido forte e se dissocia completamente em solução aquosa. A dissociação é:
H2SO4 → 2 H+ + SO42-
Para cada mol do ácido são gerados 2 mols de H+. Portanto, a concentração de íons hidrogênio será o dobro da concentração da solução diluída de ácido sulfúrico:
[H+] = 2 × 0,0005 mol/L = 0,001 mol/L
Finalmente, calculamos o pH usando a fórmula:
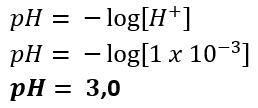
Alternativa B






