A radiação na região do infravermelho interage com a oscilação do campo elétrico gerada pelo movimento vibracional de átomos de uma ligação química. Quanto mais fortes forem as ligações e mais leves os átomos envolvidos, maior será a energia e, portanto, maior a frequência da radiação no infravermelho associada à vibração da ligação química. A estrutura química da molécula 2-amino-6-cianopiridina é mostrada.
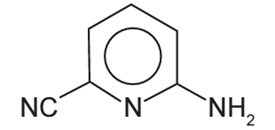
A ligação química dessa molécula, envolvendo átomos diferentes do hidrogênio, que absorve a radiação no infravermelho com maior frequência é:
A) C―C
B) C―N
C) C=C
D) C=N
E) C≡N
Solução
A capacidade de uma molécula absorver radiação na região do infravermelha é determinada pela capacidade da ligação de causar uma mudança no momento dipolar durante a vibração, a força da ligação e o tipo de ligação que ocorre entre os átomos.
A molécula em questão possui ligações químicas entre átomos diferentes de hidrogênio, como carbono (C) e nitrogênio (N). Entre essas ligações, a que absorve radiação infravermelha com maior frequência é a ligação tripla entre o carbono e o nitrogênio (C≡N). Isso ocorre porque a ligação tripla é a mais forte entre essas opções, consistindo em uma ligação sigma (σ) e duas ligações pi (π) entre o carbono e o nitrogênio. Devido à sua força e à forma como essas ligações interagem com a radiação infravermelha, a absorção nessa faixa de comprimento de onda é mais intensa para a ligação tripla C≡N.
Ligações Simples: Têm frequências de absorção geralmente mais baixas em comparação com ligações duplas e triplas.
Ligações Duplas: Têm frequências mais altas do que ligações simples.
Ligações Triplas: São as mais fortes e geralmente têm frequências de absorção ainda mais altas.
Alternativa E






