Os combustíveis de origem fóssil, como o petróleo e o gás natural, geram um sério problema ambiental, devido à liberação de dióxido de carbono durante o processo de combustão. O quadro apresenta as massas molares e as reações de combustão não balanceadas de diferentes combustíveis.
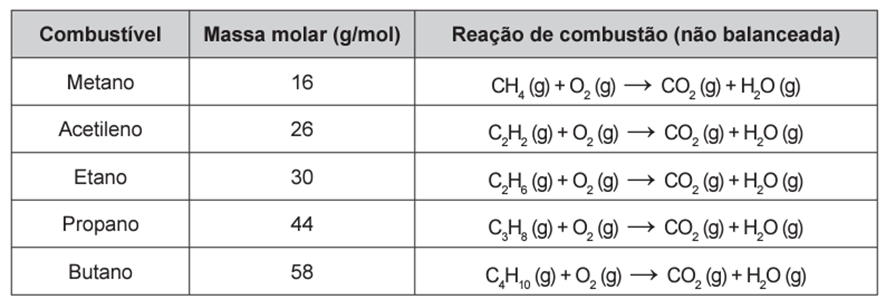
Considerando a combustão completa de 58 g de cada um dos combustíveis listados no quadro, a substância que emite mais CO2 é o
A) etano.
B) butano.
C) metano.
D) propano.
E) acetileno.
Solução
Como todo o carbono nos produtos de combustão provém do combustível, o coeficiente estequiométrico do CO₂ na reação de combustão é igual à quantidade de carbono presente na fórmula molecular de cada combustível.
Ao considerar a combustão completa de 58 g de cada combustível listado, e realizando as conversões de mol para massa usando a massa molar, é possível calcular a quantidade de CO₂ emitida por cada substância. Dessa forma, podemos determinar qual combustível é responsável pela emissão de maior quantidade de CO₂:
METANO:
16 g de CH4 ——– 1 mol de CO2
58 g de CH4 ——– x
x = 3,62 mol de CO2
ACETILENO:
26 g de C2H2 ——– 2 mol de CO2
58 g de C2H2 ——– y
y = 4,46 mol de CO2
ETANO:
30 g de C2H6 ——– 2 mol de CO2
58 g de C2H6 ——– z
z = 3,87 mol de CO2
PROPANO:
44 g de C3H8 ——– 3 mol de CO2
58 g de C3H8 ——– w
w = 3,95 mol de CO2
BUTANO:
58 g de C4H10 ——– 4 mol de CO2
58 g de C4H10 ——– k
k = 4 mol de CO2
Os cálculos indicam que o acetileno é o combustível que gera a maior quantidade de CO₂ durante a combustão para uma mesma massa.
Alternativa E






