O boato de que os lacres das latas de alumínio teriam um alto valor comercial levou muitas pessoas a juntarem esse material na expectativa de ganhar dinheiro com sua venda. As empresas fabricantes de alumínio esclarecem que isso não passa de uma “lenda urbana”, pois ao retirar o anel da lata, dificulta-se a reciclagem do alumínio. Como a liga do qual é feito o anel contém alto teor de magnésio, se ele não estiver junto com a lata, fica mais fácil ocorrer a oxidação do alumínio no forno. A tabela apresenta as semirreações e os valores de potencial padrão de redução de alguns metais:
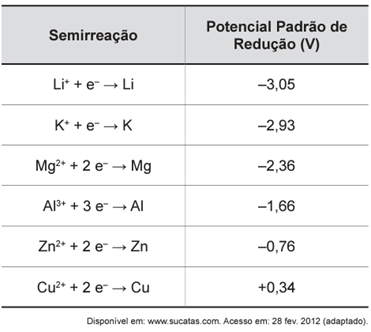
Com base no texto e na tabela, que metais poderiam entrar na composição do anel das latas com a mesma função do magnésio, ou seja, proteger o alumínio da oxidação nos fornos e não deixar diminuir o rendimento da sua reciclagem?
A) Somente o lítio, pois ele possui o menor potencial de redução.
B) Somente o cobre, pois ele possui o maior potencial de redução.
C) Somente o potássio, pois ele possui potencial de redução mais próximo do magnésio.
D) Somente o cobre e o zinco, pois eles sofrem oxidação mais facilmente que o alumínio.
E) Somente o lítio e o potássio, pois seus potenciais de redução são menores do que o do alumínio.
Solução
O magnésio (Mg), neste contexto, atua como um metal de sacrifício, o que significa que ele será oxidado no lugar do alumínio (Al). Para que isso ocorra, é necessário que o magnésio tenha um potencial de oxidação maior do que o alumínio. Sendo assim, outros metais capazes de desempenhar a mesma função do magnésio também devem apresentar potenciais de oxidação superiores (ou então menores potenciais de redução) em relação ao alumínio. Dentre os metais disponíveis na tabela fornecida, lítio (Li) e potássio (K) poderiam ser utilizados na composição dos anéis de latas, substituindo o magnésio e cumprindo a mesma função.
Alternativa E






