Um dos problemas dos combustíveis que contêm carbono é que sua queima produz dióxido de carbono. Portanto, uma característica importante, ao se escolher um combustível, é analisar seu calor de combustão (∆HoC), definido como a energia liberada na queima completa de um mol de combustível no estado padrão. O quadro seguinte relaciona algumas substâncias que contêm carbono e seu ∆HoC
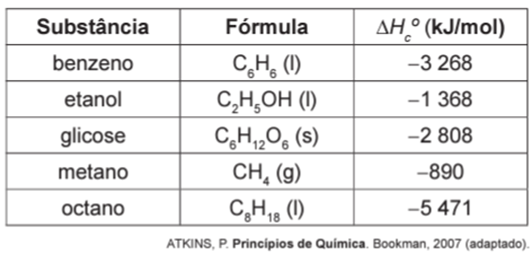
Neste contexto, qual dos combustíveis, quando queimado completamente, libera mais dióxido de carbono no ambiente pela mesma quantidade de energia produzida?
A) Benzeno.
B) Metano.
C) Glicose.
D) Octano.
E) Etanol.
Solução
Considerando uma quantidade fixa e igual de energia para todas as substâncias, podemos estabelecer uma relação entre a quantidade de CO₂ liberada e a energia produzida. Durante uma combustão completa, são gerados CO₂ e H₂O. A quantidade em mol de CO₂ produzida está diretamente relacionada ao número de átomos de carbono presentes no combustível, o que pode ser determinado através do balanceamento da reação de combustão.
Benzeno: C6H6 (l) → 6 CO2 (g) ∆HoC = – 3 268 kJ
3 268 kJ de energia liberada ———– 6 mol de CO2
1 kJ de energia liberada —————– x
x = 0,0018 mol de CO2
Etanol: C2H5OH (l) → 2 CO2 (g) ∆HoC = – 1 368 kJ
1 368 kJ de energia liberada ———– 2 mol de CO2
1 kJ de energia liberada —————– y
y = 0,0014 mol de CO2
Glicose: C6H12O6 (s) → 6 CO2 (g) ∆HoC = – 2 808 kJ
2 808 kJ de energia liberada ———– 6 mol de CO2
1 kJ de energia liberada —————– w
w = 0,0021 mol de CO2
Metano: CH4 (g) → CO2 (g) ∆HoC = – 890 kJ
890 kJ de energia liberada ———– 1 mol de CO2
1 kJ de energia liberada ————— z
z = 0,0011 mol de CO2
Octano: C8H18 (l) → 8 CO2 (g) ∆HoC = – 5 471 kJ
5 471 kJ de energia liberada ———– 8 mol de CO2
1 kJ de energia liberada ————— k
k = 0,0014 mol de CO2
A glicose libera mais dióxido de carbono, considerando a mesma quantidade de energia produzida (1 kJ)
Alternativa C






