As misturas efervescentes, em pó ou em comprimidos, são comuns para a administração de vitamina C ou de medicamentos para azia. Essa forma farmacêutica sólida foi desenvolvida para facilitar o transporte, aumentar a estabilidade de substâncias e, quando em solução, acelerar a absorção do fármaco pelo organismo. As matérias-primas que atuam na efervescência são, em geral, o ácido tartárico ou o ácido cítrico que reagem com um sal de caráter básico, como o bicarbonato de sódio (NaHCO3), quando em contato com a água. A partir do contato da mistura efervescente com a água, ocorre uma série de reações químicas simultâneas: liberação de íons, formação de ácido e liberação do gás carbônico — gerando a efervescência.
As equações a seguir representam as etapas da reação da mistura efervescente na água, em que foram omitidos os estados de agregação dos reagentes, e H3A representa o ácido cítrico.
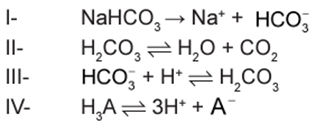
A ionização, a dissociação iônica, a formação do ácido e a liberação do gás ocorrem, respectivamente, nas seguintes etapas:
A) IV, I, II e III
B) I, IV, III e II
C) IV, III, I e II
D) I, IV, II e III
E) IV, I, III e II
Solução
A ionização ocorre quando moléculas (formadas por ligações covalentes), como os hidrácidos por exemplo, se dissolvem em água e formando íons. Os íons não existiam previamente e foram formados após o contato com a água.
Exemplo: H3A ⇌ 3 H+ + A– (ETAPA IV)
A dissociação iônica acontece com compostos iônicos (formados por ligações iônicas. Quando dissolvidos em água, eles se separam em íons positivos (cátions) e negativos (ânions).
Exemplo: NaHCO3 ⇌ Na+ + HCO3– (ETAPA I)
A formação de um ácido ocorre quando o H⁺ do meio estabelece uma ligação química com outra espécie.
Exemplo: HCO3– + H+ ⇌ H2CO3 (ETAPA III)
A liberação de gás ocorre quando um dos produtos formados se encontra no estado gasoso.
Exemplo: H2CO3 ⇌ H2O + CO2 (ETAPA II)
Alternativa E






