No que tange à tecnologia de combustíveis alternativos, muitos especialistas em energia acreditam que os álcoois vão crescer em importância em um futuro próximo. Realmente, álcoois como metanol e etanol têm encontrado alguns nichos para uso doméstico como combustíveis há muitas décadas e, recentemente, vêm obtendo uma aceitação cada vez maior como aditivos, ou mesmo como substitutos para gasolina em veículos. Algumas das propriedades físicas desses combustíveis são mostradas no quadro seguinte.
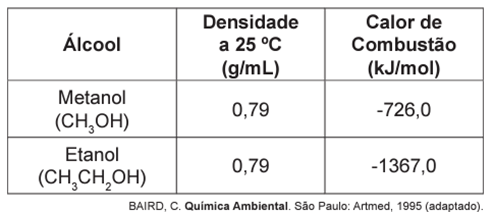
Dados: Massas molares em g/mol: H = 1,0; C = 12,0; O = 16,0.
Considere que, em pequenos volumes, o custo de produção de ambos os álcoois seja o mesmo. Dessa forma, do ponto de vista econômico, é mais vantajoso utilizar
A) metanol, pois sua combustão completa fornece aproximadamente 22,7 kJ de energia por litro de combustível queimado.
B) etanol, pois sua combustão completa fornece aproximadamente 29,7 kJ de energia por litro de combustível queimado.
C) metanol, pois sua combustão completa fornece aproximadamente 17,9 MJ de energia por litro de combustível queimado.
D) etanol, pois sua combustão completa fornece aproximadamente 23,5 MJ de energia por litro de combustível queimado.
E) etanol, pois sua combustão completa fornece aproximadamente 33,7 MJ de energia por litro de combustível queimado.
Solução
Considerando que a densidade do metanol e do etanol é de 0,79 g/mL, a massa de cada combustível em um volume de 1000 mL (1 L) é de 790 g.
0,79 g ——– 1 mL
x ————– 1000 mL
x = 790 g de metanol e também de etanol (possuem a mesma densidade)
Se 790 g de metanol (com massa molar de 32 g/mol) estão presentes em 1 L de combustível, a energia liberada por litro pode ser calculada a partir dessa massa:
32 g ———— 726,0 kJ de energia liberada
790 g ———- y
y = 17.923,1 kJ de energia liberada a cada 1 L do combustível metanol
Podemos utilizar o mesmo raciocínio para o etanol. Se 790 g de etanol (com massa molar de 46 g/mol) estão presentes em 1 L de combustível, a energia liberada por litro, calculada a partir de uma relação com a massa é de:
46 g ———— 1367,0 kJ de energia liberada
790 g ———- z
z = 23.476,7 kJ de energia liberada a cada 1 L do combustível etanol
Do ponto de vista econômico, é mais vantajoso utilizar etanol, porque sua combustão completa fornece aproximadamente 23,5 MJ de energia a cada litro de combustível queimado.
Alternativa D






