Para que apresente condutividade elétrica adequada a muitas aplicações, o cobre bruto obtido por métodos térmicos é purificado eletroliticamente. Nesse processo, o cobre bruto impuro constitui o ânodo da célula, que está imerso em uma solução de CuSO4. À medida que o cobre impuro é oxidado no ânodo, íons Cu2+ da solução são depositados na forma pura no cátodo. Quanto às impurezas metálicas, algumas são oxidadas, passando à solução, enquanto outras simplesmente se desprendem do ânodo e se sedimentam abaixo dele. As impurezas sedimentadas são posteriormente processadas, e sua comercialização gera receita que ajuda a cobrir os custos do processo. A série eletroquímica a seguir lista o cobre e alguns metais presentes como impurezas no cobre bruto de acordo com suas forças redutoras relativas.
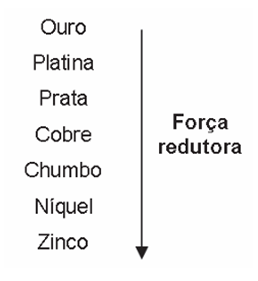
Entre as impurezas metálicas que constam na série apresentada, as que se sedimentam abaixo do ânodo de cobre são
A) Au, Pt, Ag, Zn, Ni e Pb.
B) Au, Pt e Ag.
C) Zn, Ni e Pb.
D) Au e Zn.
E) Ag e Pb
Solução
Se a impureza está sedimentando, significa que está ganhando elétrons e sendo reduzida à sua forma metálica (NOX = 0). Portanto, o cobre (Cu) deverá sofrer oxidação para que o outro íon metálico seja reduzido.
Quem possui a maior força redutora tende a sofrer oxidação, já que a força redutora significa a capacidade de reduzir o outro.
Sendo assim, ouro (Au), platina (Pt) e prata (Ag), por apresentarem maiores potenciais de redução (menor força redutora) que o Cu, serão reduzidos.
Alternativa B






