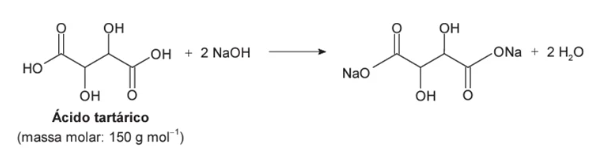
O ácido tartárico é o principal ácido do vinho e está diretamente relacionado com sua qualidade. Na avaliação de um vinho branco em produção, uma analista neutralizou uma alíquota de 25,0 mL do vinho com NaOH a 0,10 mol L−1, consumindo um volume igual a 8,0 mL dessa base. A reação para esse processo de titulação é representada pela equação química:
A concentração de ácido tartárico no vinho analisado é mais próxima de:
A) 1,8 g L−1
B) 2,4 g L−1
C) 3,6 g L−1
D) 4,8 g L−1
E) 9,6 g L−1
Solução
Durante a titulação, uma substância de concentração conhecida (no caso o NaOH) é utilizada para descobrir a concentração desconhecida da outra substância (no caso o HCl), a partir de uma reação química.
Sabemos que foram consumidos 8,0 mL da base, de concentração 0,10 mol L-1. A partir disso, é possível calcular qual foi a quantidade de matéria (número de mol) de base que reagiu:
MOL VOLUME
0,10 mol ————- 1000 mL (1L)
X ——————— 8 mL
X = 0,0008 mol (quantidade de matéria de NaOH que reagiu com o ácido)
A partir da reação química fornecida, temos a proporção molar entre os reagentes e ela deve ser levada em conta para o próximo cálculo. Sabemos que 1 mol do ácido reage com 2 mol da base. Considerando que 1 mol do ácido possui massa molar igual a 150 g mol-1, podemos estabelecer a seguinte relação:
MASSA DO ÁCIDO MOL DE BASE
150 g ————————— 2 mol
m ——————————- 0,0008 mol
m = 0,06 g (massa do ácido tartárico que reagiu com 0,0008 mol da base).
Uma vez que a massa calculada para o ácido estava presente em uma alíquota de 25,0 mL de vinho, é possível calcular qual a massa do ácido estará presente em 1000 mL (1L), sendo, portanto, a concentração em mol L-1:
MASSA DO ÁCIDO VOLUME
0,06 g ————————— 25,0 mL
Y ——————————— 1000 mL
Y = 2,4 g de ácido tartárico.
Como a massa de 2,4 g está presente em 1L, dizemos que a concentração do ácido tartárico no vinho é de 2,4 g L-1.
Alternativa B






