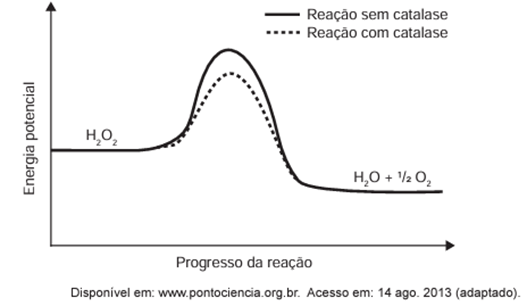
O peróxido de hidrogênio é um produto secundário do metabolismo celular e apresenta algumas funções úteis, mas, quando em excesso, é prejudicial, gerando radicais que são tóxicos para as células. Para se defender, o organismo vivo utiliza a enzima catalase, que decompõe H2O2 em H2O e O2. A energia de reação de decomposição, quando na presença e ausência da catalase, está mostrada no gráfico.
Na situação descrita, o organismo utiliza a catalase porque ela
A) diminui a energia de ativação.
B) permite maior rendimento da reação.
C) diminui o valor da entalpia da reação.
D) consome rapidamente o oxigênio do reagente.
E) reage rapidamente com o peróxido de hidrogênio.
Solução
As enzimas são catalisadores biológicos que aceleram as reações químicas no organismo. Elas atuam reduzindo a energia de ativação necessária para que uma reação ocorra, o que resulta em uma aceleração significativa da velocidade dessa reação.
No gráfico, observa-se que a reação catalisada pela enzima catalase apresenta uma energia de ativação menor em comparação com a não catalisada, o que leva a uma decomposição mais rápida da água oxigenada.
Alternativa A






