Um marceneiro esqueceu um pacote de pregos ao relento, expostos à umidade do ar e à chuva. Com isso, os pregos de ferro, que tinham a massa de 5,6 g cada, acabaram cobertos por uma camada espessa de ferrugem (Fe₂O₃⋅H₂O), uma substância marrom insolúvel, produto da oxidação do ferro metálico, que ocorre segundo a equação química:
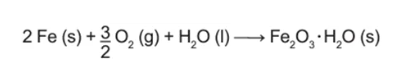
Considere as massas molares (g/mol): H = 1; O = 16; Fe = 56.
Qual foi a massa de ferrugem produzida ao se oxidar a metade (50%) de um prego?
A) 4,45 g
B) 8,90 g
C) 17,80 g
D) 72,00 g
E) 144,00 g
Solução
A massa de um prego de ferro (Fe) é igual a 5,6 g. Se metade (50%) do prego será oxidado, precisamos considerar somente a metade da massa: 2,8 g.
Pela relação estequiométrica, 2 mol de ferro forma 1 mol de ferrugem (Fe₂O₃⋅H₂O).
Sabendo que massa de 2 mol de ferro é igual a 112 g (duas vezes a massa molar) e a massa de 1 mol de ferrugem é de 178 g, podemos estabelecer a seguinte relação:
MASSA Fe MASSA FERRUGEM
112 g —————— 178 g
2,8 g ——————- x
x = 4,45 g de ferrugem produzida ao se oxidar metade de um prego.
Alternativa A






