Sabões são sais de ácidos carboxílicos de cadeia longa utilizados com a finalidade de facilitar, durante processos de lavagem, a remoção de substâncias de baixa solubilidade em água, por exemplo, óleos e gorduras. A figura a seguir representa a estrutura de uma molécula de sabão
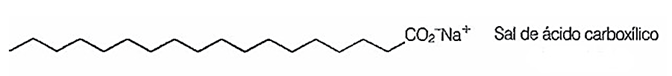
Em solução, os ânions do sabão podem hidrolisar a água e, desse modo, formar o ácido carboxílico correspondente. Por exemplo, para o estearato de sódio, é estabelecido o seguinte equilíbrio:
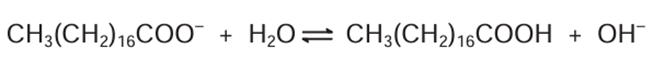
Uma vez que o ácido carboxílico formado é pouco solúvel em água e menos eficiente na remoção de gorduras, o pH do meio deve ser controlado de maneira a evitar que o equilíbrio acima seja deslocado para a direita.
Com base nas informações do texto, é correto concluir que os sabões atuam de maneira
A) mais eficiente em pH básico.
B) mais eficiente em pH ácido.
C) mais eficiente em pH neutro.
D) eficiente em qualquer faixa de pH.
E) mais eficiente em pH ácido ou neutro.
Solução
Tendo em vista que o ácido carboxílico formado (CH3(CH2)16COOH) é menos solúvel em água e menos eficiente na remoção de gorduras, devemos evitar que o equilíbrio químico favoreça a reação direta, ou seja, devemos evitar o seu deslocamento para o lado direito. Por consequência, o equilíbrio deve, preferencialmente, se deslocar para o lado esquerdo, favorecendo a formação do CH3(CH2)16COO–, que é mais eficiente para remover gorduras, além de apresentar maior solubilidade em água.
De acordo com o Princípio de Le Chatelier, ao perturbarmos um equilíbrio, a tendência é que o sistema responda de forma contrária, no sentido de amenizar o efeito daquela perturbação. Portanto, ao elevar a concentração de uma espécie, o equilíbrio deverá deslocar para o lado oposto daquela mesma espécie, no sentido do seu consumo.
Logo, concluímos que os sabões atuam melhor em pH básico. Ao aumentarmos o pH, aumenta-se também a concentração de íons OH– e o sentido de consumo desses íons é justamente o lado esquerdo da reação (sentido inverso, em que se tem a formação do CH3(CH2)16COO– favorecida)
Alternativa A






