O ácido acetilsalicílico, AAS (massa molar igual a 180 g/mol), é sintetizado a partir da reação do ácido salicílico (massa molar igual a 138 g/mol) com anidrido acético, usando-se ácido sulfúrico como catalisador, conforme a equação química:
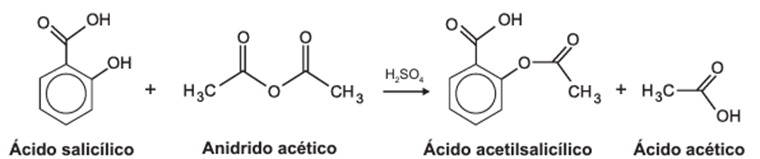
Após a síntese, o AAS é purificado e o rendimento final é de aproximadamente 50%. Devido às suas propriedades farmacológicas (antitérmico, analgésico, anti-inflamatório e antitrombótico), o AAS é utilizado como medicamento na forma de comprimidos, nos quais se emprega tipicamente uma massa de 500 mg dessa substância.
Uma indústria farmacêutica pretende fabricar um lote de 900 mil comprimidos, de acordo com as especificações do texto. Qual é a massa de ácido salicílico, em kg, que deve ser empregada para esse fim?
A) 293
B) 345
C) 414
D) 690
E) 828
Solução
Primeiramente, precisamos calcular a massa de AAS presente em 900 mil comprimidos:
1 comprimido de AAS —————— 500 mg
900.000 comprimidos de AAS ——– x
x = 450.00.000 mg = 450 kg de AAS
Pela estequiometria, 1 mol de ácido salicílico (138 g/mol) forma 1 mol de AAS (180 g/mol). A relação entre as massas nos diz que:
ÁCIDO SALICÍLICO AAS
138 g ———————————- 180 g
y —————————————- 450 kg
y = 345 kg de ácido salicílico
O cálculo anterior indica que para produzir 450 kg de AAS, são necessários 345 kg de ácido salicílico, assumindo um rendimento de 100%. No entanto, como a reação possui um rendimento real de apenas 50%, é necessário utilizar uma quantidade maior de reagente para garantir que, ao considerar o rendimento efetivo, serão obtidos os 450 kg de AAS desejados. Portanto:
50% —————- 345 kg de ácido salicílico
100% ————– z
z = 690 kg de ácido salicílico
Alternativa D






