Os airbags de segurança dos automóveis são acionados com o impacto, que envia um sinal elétrico para o dispositivo e inicia a reação explosiva do trinitreto de sódio (NaN3), produzindo sódio metálico e nitrogênio molecular, conforme a equação:

O gás produzido tem função de inflar o airbag. Esse tipo de dispositivo contém, aproximadamente, 100 g de NaN3.
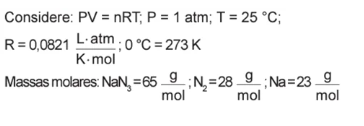
Nesse dispositivo, o volume de gás produzido, em litro, é
A) 4,7.
B) 9,4.
C) 18,8.
D) 56,5.
E) 113,0.
Solução
Primeiramente, precisamos descobrir a quantidade de mol do N2 produzida a partir de 100 g de NaN3. De acordo com a estequiometria, considerando que 130 g (2 mol) de NaN3 formam 3 mol de N2 temos que:
MASSA DE NAN3 MOL DE N2
130 g ———————— 3 mol
100 g ———————— x
x = 2,31 mol de N2
Uma vez obtido o número de mol de N2, basta calcular o volume com a relação fornecida pela questão (pV = nRT)
Substituindo os valores e considerando a temperatura em Kelvin, temos que:

Alternativa D






