O ferro é encontrado na natureza na forma de seus minérios, tais como a hematita (α-Fe2O3), a magnetita (Fe3O4) e a wustita (FeO). Na siderurgia, o ferro-gusa é obtido pela fusão de minérios de ferro em altos fornos em condições adequadas. Uma das etapas nesse processo é a formação de monóxido de carbono. O CO (gasoso) é utilizado para reduzir o FeO (sólido), conforme a equação química:
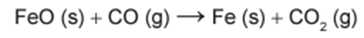
Considere as seguintes equações termoquímicas:
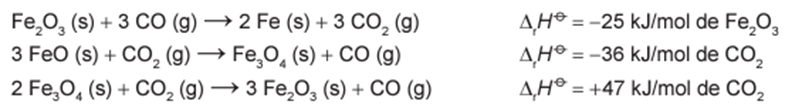
O valor mais próximo de ∆rH⦵, em kJ/mol de FeO, para a reação indicada do FeO (sólido) com o CO (gasoso) é
A) −14.
B) −17.
C) −50.
D) −64.
E) −100.
Solução
O calor de reação para a reação entre FeO e CO pode ser determinado utilizando a Lei de Hess. Isso é feito combinando as reações fornecidas, que representam as etapas intermediárias de uma equação global.
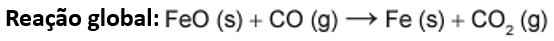
Para que as etapas resultem no processo global, anteriormente descrito, devemos realizar as seguintes manipulações:
– Precisamos de 1 mol de FeO (s) na posição dos reagentes. A etapa 2 deve ser dividida por 3, incluindo o valor do ΔH.
– Precisamos de 1 mol de Fe (s) na posição dos reagentes. A etapa 1 deve ser dividida por 2, incluindo o valor do ΔH correspondente.
– A etapa 3 deve ser dividida por 6 para que o Fe3O4 e o Fe2O3 sejam corretamente “cortados” pois não aparecem na equação global.
– Após os 3 passos anteriores, CO e o CO2 ficarão ajustados conforme na equação global.
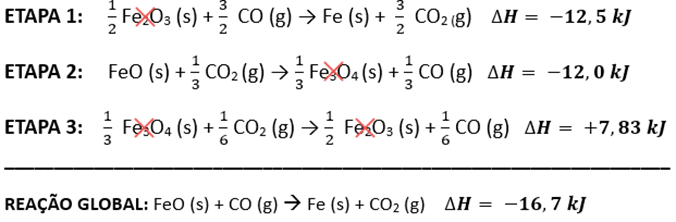
O ∆rH⦵ para o processo global é mais próximo de -17 kJ.
Alternativa B






