Na busca por ouro, os garimpeiros se confundem facilmente entre o ouro verdadeiro e o chamado ouro de tolo, que tem em sua composição 90% de um minério chamado pirita (FeS2). Apesar do engano, a pirita não é descartada, pois é utilizada na produção do ácido sulfúrico, que ocorre com rendimento global de 90%, conforme as equações químicas apresentadas. Considere as massas molares: FeS2 (120 g/mol), O2 (32 g/mol), SO2 (64 g/mol), SO3 80 (g/mol), H2O (18 g/mol), H2SO4 (98 g/mol).
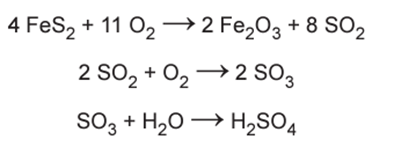
Qual é o valor mais próximo da massa de ácido sulfúrico, em quilograma, que será produzida a partir de 2,0 kg de ouro de tolo?
A) 0,33
B) 0,41
C) 2,6
D) 2,9
E) 3,3
Solução
Considerando a reação global, temos:
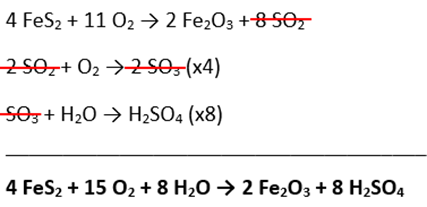
Na reação, observamos que 4 mol de FeS₂ produzem 8 mol de H₂SO₄. Para calcular a massa de ácido formada a partir de 2 kg de ouro de tolo, precisamos considerar tanto a relação estequiométrica, quanto a pureza do material. Como o ouro de tolo contém 90% de FeS₂, devemos levar em conta essa pureza. Assim, temos que:
100% ———— 2 kg de ouro de tolo
90 % ————- x (massa de FeS2)
x = 1,8 kg de FeS2 (massa que vai reagir para formar o ácido).
De acordo com a estequiometria:
– 4 mol de FeS2 = 480 g (massa molar = 120 g/mol)
– 8 mol de H2SO4 = 784 g (massa molar 98 g/mol)
4 mol FeS2 8 mol H2SO4
480 g ———————– 784 g
1,8 kg ———————- y
y = 2,94 kg de H2SO4 produzidos.
Considerando que a reação apresenta um rendimento de 90%, temos a massa final de H2SO4 dada por:
2,94 kg ————- 100%
z ——————— 90%
z = 2,64 kg de H2SO4.
Alternativa C






