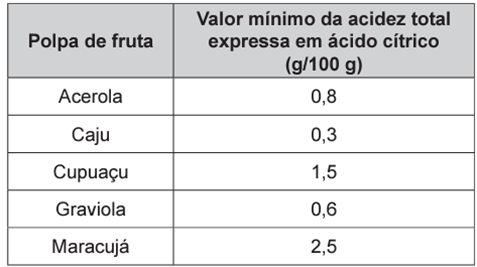
Um dos parâmetros de controle de qualidade de polpas de frutas destinadas ao consumo como bebida é a acidez total expressa em ácido cítrico, que corresponde à massa dessa substância em 100 gramas de polpa de fruta. O ácido cítrico é uma molécula orgânica que apresenta três hidrogênios ionizáveis (ácido triprótico) e massa molar 192 g mol−1. O quadro indica o valor mínimo desse parâmetro de qualidade para polpas comerciais de algumas frutas.
A acidez total expressa em ácido cítrico de uma amostra comercial de polpa de fruta foi determinada. No procedimento, adicionou-se água destilada a 2,2 g da amostra e, após a solubilização do ácido cítrico, o sólido remanescente foi filtrado. A solução obtida foi titulada com solução de hidróxido de sódio 0,01 mol L−1, em que se consumiram 24 mL da solução básica (titulante).
BRASIL. Ministério da Agricultura e do Abastecimento. Instrução
normativa n. 1, de 7 de janeiro de 2000. Disponível em:
www.agricultura.gov.br. Acesso em: 9 maio 2019 (adaptado).
Entre as listadas, a amostra analisada pode ser de qual polpa de fruta?
A) Apenas caju.
B) Apenas maracujá.
C) Caju ou graviola.
D) Acerola ou cupuaçu.
E) Cupuaçu ou graviola.
Solução
Inicialmente, vamos calcular a quantidade em mol de base (NaOH) utilizada na titulação. Sabemos que o volume de base utilizado foi de 24 mL e a concentração do NaOH é de 0,01 mol/L. Portanto, podemos calcular da seguinte forma:
VOLUME MOL
1000 mL ———– 0,01 mol de NaOH
24 mL ————— x mol de NaOH
x = 0,00024 mol de NaOH (ou 2,4 x 10-4 mol)
Sabendo que o ácido cítrico (representado por H3A) é triprótico, com 3 hidrogênios ionizáveis, podemos propor a seguinte reação de neutralização balanceada:
BASE + ÁCIDO → SAL + ÁGUA
3 NaOH (aq) + H3A (aq) → Na3A (aq) + 3 H2O (l)
Isso significa que para neutralizar 1 mol de ácido (H3A), são necessários 3 mol de base (NaOH). A partir disso, é possível calcular a quantidade em mols de ácido cítrico presente em 2,2 g da amostra da polpa de fruta:
3 mol de NaOH —————- 1 mol de ácido cítrico
2,4 x 10-4 mol de NaOH ——- y mol de ácido cítrico
y = 8 x 10-5 mol de ácido cítrico (ou 0,00008 mol)
Transformando a quantidade em mol para massa:
MOL MASSA
1 mol do ácido ————— 192 g
8 x 10-5 mol do ácido ——- m
m = 0,01536 g de ácido cítrico.
A partir do cálculo anterior, sabemos que em 2,2 g da polpa da fruta tem-se 0,01536 g de ácido cítrico. Logo, a massa de ácido presente em 100 g da polpa será de:
MASSA DA POLPA MASSA DO ÁCIDO
2,2 g —————————– 0,01536 g
100 g —————————- z
z = 0,69 g (valor da acidez total em 100g de polpa)
Conforme a tabela fornecida e os cálculos realizados, o valor mínimo da acidez total para as polpas de fruta deve ser de 0,69 g a cada 100 g de amostra. Amostras que apresentam valor mínimo de acidez maior que o calculado não devem ser consideradas. Com isso, concluímos que a amostra analisada pode ser de caju ou graviola.
Alternativa C






