A presença de substâncias ricas em enxofre, como a pirita (FeS2), em áreas de mineração, provoca um dos mais preocupantes impactos causados pela exploração dos recursos naturais da crosta terrestre. Em contato com o oxigênio atmosférico, o sulfeto sofre oxidação em diversas etapas até formar uma solução aquosa conhecida como drenagem ácida de minas, de acordo com a equação química descrita.
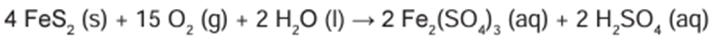
Um dos processos de intervenção nesse problema envolve a reação do resíduo ácido com uma substância básica, de baixa solubilidade em meio aquoso, e sem a geração de subprodutos danosos ao meio ambiente.
FIGUEIREDO, B. R. Minérios e ambientes. Campinas: Unicamp, 2000.
Esse processo de intervenção é representado pela equação química:
A) Ca (s) + 2 H2O (l) → Ca(OH)2 (aq) + H2 (g).
B) CaO (s) + H2SO4 (aq) → CaSO4 (aq) + H2O (l).
C) CaCO3 (s) + H2SO4 (aq) → CaSO4 (aq) + H2O (l) + CO2 (g).
D) CaSO4 (s) + H2SO4 (aq) → Ca2+ (aq) + 2 H+ (aq) + 2 SO42− (aq).
E) Ca(HCO3)2 (s) + 2 H2O (l) → Ca(OH)2 (aq) + 2 H2O (l) + 2 CO2 (g).
Solução
O processo de intervenção envolve a reação do resíduo ácido (H₂SO₄) com uma substância de caráter básico e de baixa solubilidade em água, como o óxido de cálcio (CaO). Além do mais, é importante que a reação não produza subprodutos prejudiciais ao meio ambiente, como o CO₂, por exemplo.
Alternativa B






