Nas últimas décadas, o efeito estufa tem-se intensificado de maneira preocupante, sendo esse efeito muitas vezes atribuído à intensa liberação de CO2 durante a queima de combustíveis fósseis para geração de energia. O quadro traz as entalpias-padrão de combustão a 25 oC (HΔo25) do metano, do butano e do octano.
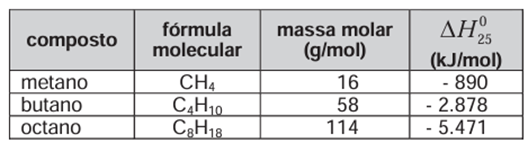
À medida que aumenta a consciência sobre os impactos ambientais relacionados ao uso da energia, cresce a importância de se criar políticas de incentivo ao uso de combustíveis mais eficientes. Nesse sentido, considerando-se que o metano, o butano e o octano sejam representativos do gás natural, do gás liquefeito de petróleo (GLP) e da gasolina, respectivamente, então, a partir dos dados fornecidos, é possível concluir que, do ponto de vista da quantidade de calor obtido por mol de CO2 gerado, a ordem crescente desses três combustíveis é
A) gasolina, GLP e gás natural.
B) gás natural, gasolina e GLP.
C) gasolina, gás natural e GLP.
D) gás natural, GLP e gasolina.
E) GLP, gás natural e gasolina.
Solução
O CO2 é proveniente de combustão completa, portanto devemos realizar um cálculo da quantidade de calor obtido por mol de CO2 (1 mol) para cada um dos combustíveis:
METANO: CH4(g) + 2 O2(g) à CO2(g) + 2 H2O(l)
Durante a combustão completa de 1 mol de metano (CH4), é formado 1 mol de CO2. Portanto, a quantidade de calor liberada é de 890 kJ/mol.
BUTANO: C4H10(g) + 6,5 O2(g) à 4 CO2(g) + 5 H2O(l)
Durante a combustão completa de 1 mol de butano (C4H10), são formados 4 mol de CO2 e a quantidade de calor liberada no processo é de 2.878 kJ/mol. Porém, precisamos saber qual a quantidade de calor gerado, proporcionalmente, para 1 mol de CO2. Sendo assim, temos que:
MOL ΔH
4 mol de CO2 ————- 2.878 kJ/mol
1 mol de CO2 ————- X
X = 719,5 kJ/mol
OCTANO: C8H18(g) + 12,5 O2(g) à 8 CO2(g) + 9 H2O(l)
Durante a combustão completa de 1 mol de octano (C8H18), são formados 8 mol de CO2 e a quantidade de calor liberada no processo é de 5.471 kJ/mol. Porém, precisamos saber qual a quantidade de calor gerado, proporcionalmente, para 1 mol de CO2. Sendo assim, temos que:
MOL ΔH
8 mol de CO2 ————- 5.471 kJ/mol
1 mol de CO2 ————- Y
Y = 683,9 kJ/mol
Portanto, concluímos que a ordem crescente de calor produzido por mol de CO2 é: gasolina (octano) < GLP (butano) < gás natural (metano).
Alternativa A






