O benzeno, um importante solvente para a indústria química, é obtido industrialmente pela destilação do petróleo. Contudo, também pode ser sintetizado pela trimerização do acetileno catalisada por ferro metálico sob altas temperaturas, conforme a equação química:
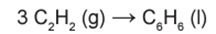
A energia envolvida nesse processo pode ser calculada indiretamente pela variação de entalpia das reações de combustão das substâncias participantes, nas mesmas condições experimentais:
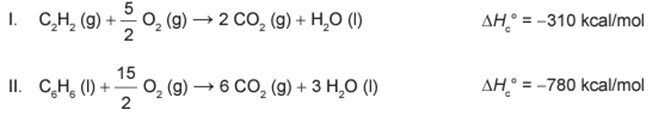
A variação de entalpia do processo de trimerização, em kcal, para a formação de um mol de benzeno é mais próxima de
A) −1 090.
B) −150.
C) −50.
D) +157.
E) +470.
Solução
A resolução da questão envolvendo cálculo da variação de entalpia por Lei de Hess. A partir de manipulações nos processos intermediários, podemos chegar na equação global e em seguida obter o valor de ΔH.
A equação global é dada por:
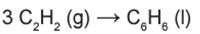
Para que tenhamos 3 mol de C2H2 na posição dos reagentes, devemos multiplicar a equação I por 3, incluindo o valor do ΔHoc.
Para que tenhamos 1 mol de C6H6 na posição dos produtos, devemos inverter a equação II e também o sinal da variação de entalpia.
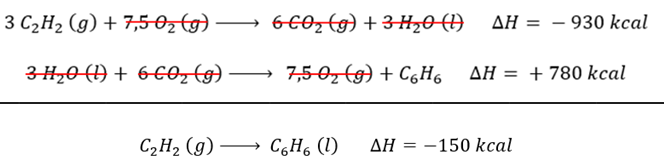
Alternativa B






