O urânio é um elemento cujos átomos contêm 92 prótons, 92 elétrons e entre 135 e 148 nêutrons. O isótopo de urânio 235U é utilizado como combustível em usinas nucleares, onde, ao ser bombardeado por nêutrons, sofre fissão de seu núcleo e libera uma grande quantidade de energia (2,35×1010 kJ/mol). O isótopo 235U ocorre naturalmente em minérios de urânio, com concentração de apenas 0,7%. Para ser utilizado na geração de energia nuclear, o minério é submetido a um processo de enriquecimento, visando aumentar a concentração do isótopo 235U para, aproximadamente, 3% nas pastilhas. Em décadas anteriores, houve um movimento mundial para aumentar a geração de energia nuclear buscando substituir, parcialmente, a geração de energia elétrica a partir da queima do carvão, o que diminui a emissão atmosférica de CO2 (gás com massa molar igual a 44 g/mol). A queima do carvão é representada pela equação química:
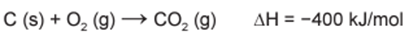
Qual é a massa de CO2, em toneladas, que deixa de ser liberada na atmosfera, para cada 100 g de pastilhas de urânio enriquecido utilizadas em substituição ao carvão como fonte de energia?
A) 2,10
B) 7,70
C) 9,00
D) 33,0
E) 300
Solução
A massa de CO2, em toneladas, que deixa de ser liberada na atmosfera, para cada 100 g de pastilhas de urânio enriquecido utilizadas em substituição ao carvão como fonte de energia pode ser calculada da seguinte forma: 100 g de pastilhas de urânio possuem 3% de urânio-235. Isso significa que a massa de urânio enriquecido presente em cada pastilha de 100 g é igual a 3 g.
Quando o urânio-235 sofre fissão, a energia liberada é de 2,35×1010 kJ/mol. Isso significa que:
235 g de U (1 mol) ———- 2,35×1010 kJ de energia liberada
3 g de U ———————— x
x = 3 x 108 kJ de energia liberados por 3 g de U-235.
O cálculo da massa do CO2 que deixa de ser liberada depende da equação química balanceada da combustão do C. Para cada 1 mol de CO2 (44 g/mol) formado, são liberados 400 kJ de energia. Agora, precisamos calcular qual a massa de CO2 liberaria a mesma quantidade de energia do U-235. Essa massa é justamente a quantidade economizada.
400 kJ de energia liberada ———- 44 g de CO2
3 x 108 kJ de energia liberada —— y
y = 33,0 x 106 g, aproximadamente 33 toneladas
Alternativa D






