A reciclagem exerce impacto considerável sobre a eficiência energética. Embora restaurar materiais que foram descartados também consuma energia, é possível que essa energia seja substancialmente menor. O gráfico seguinte indica a quantidade de energia necessária para a produção de materiais primários e reciclados. A maioria dos metais ocorre na crosta terrestre como óxidos que devem ser reduzidos para recuperar o metal elementar, o que consome grande quantidade de energia. As entalpias-padrão de formação dos óxidos de alumínio e ferro são, respectivamente: -1 675,7 kJ/mol e -824,2 kJ/mol.
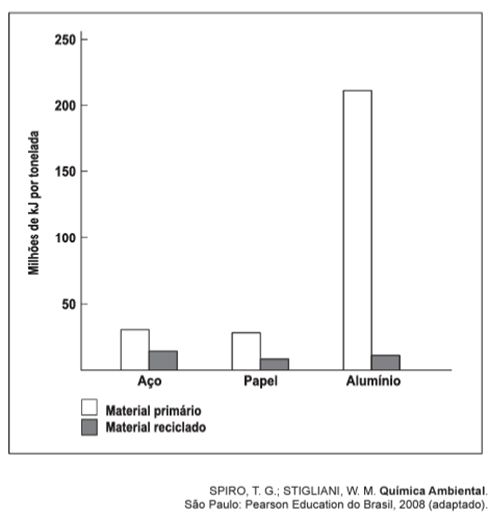
A energia gasta na obtenção do alumínio a partir do seu material primário é maior do que a do aço, porque o alumínio
A) forma seu óxido absorvendo menos energia que o ferro.
B) requer 200 vezes mais energia para ser isolado do seu minério do que o ferro.
C) requer praticamente o dobro de energia para ser isolado do seu óxido do que requer o ferro, no estado padrão.
D) apresenta entalpia de formação no seu óxido menor do que a entalpia do ferro.
E) apresenta somente uma valência constante, enquanto o ferro pode apresentar normalmente duas valências.
Solução
A partir dos valores fornecidos para a entalpia padrão de formação dos óxidos de alumínio e ferro, observamos que a entalpia de formação do óxido de alumínio é -1675 kJ/mol, enquanto a do óxido de ferro é -824 kJ/mol. Isso indica que a formação do óxido de alumínio libera mais energia do que a formação do óxido de ferro.
Porém, se invertemos as reações para considerar o processo contrário, de decomposição dos óxidos (reações endotérmicas), podemos concluir que o valor energético necessário para a decomposição do óxido de alumínio é maior do que o requerido para a decomposição do óxido de ferro.
2 Al2O3 → 2 Al + 3 O2 ΔH = + 1675,7 kJ/mol
2 Fe2O3 → 4 Fe + 3 O2 ΔH = + 824,2 kJ/mol
O fato da entalpia de formação do Al2O3 ser mais negativa (−1675,7 kJ/mol kJ/mol) indica que a reação de formação do óxido de alumínio é altamente exotérmica. Quando consideramos o processo inverso, ou seja, a decomposição do óxido de alumínio para formar alumínio metálico, a energia requerida será maior (mais positiva).
Para avaliar a energia envolvida no processo inverso de decomposição, basta inverter o sinal das entalpias de formação correspondentes. Isso reflete a quantidade de energia que será necessária para reverter a formação do composto.
Alternativa D






