A hidroponia pode ser definida como uma técnica de produção de vegetais sem necessariamente a presença de solo. Uma das formas de implementação é manter as plantas com suas raízes suspensas em meio líquido, de onde retiram os nutrientes essenciais. Suponha que um produtor de rúcula hidropônica precise ajustar a concentração do íon nitrato (NO3−) para 0,009 mol/L em um tanque de 5 000 litros e, para tanto, tem em mãos uma solução comercial nutritiva de nitrato de cálcio 90 g/L. As massas molares dos elementos N, O e Ca são iguais a 14 g/mol, 16 g/mol e 40 g/mol, respectivamente.
Qual o valor mais próximo do volume da solução nutritiva, em litros, que o produtor deve adicionar ao tanque?
A) 26
B) 41
C) 45
D) 51
E) 82
Solução
Para determinar o volume da solução nutritiva necessário para ajustar a concentração do íon nitrato (NO₃⁻) no tanque de 5.000 litros para 0,009 mol/L, podemos raciocinar da seguinte forma:
A solução nutritiva é composta por nitrato de cálcio, Ca(NO₃)₂. Primeiro, precisamos determinar a concentração de NO₃⁻ na solução nutritiva.
– A massa molar do Ca(NO₃)₂ é de 164 g/mol e a concentração da solução nutritiva de Ca(NO₃)₂ é igual a 90 g/L.
– A concentração molar de Ca(NO₃)₂ é dada por:
1 mol de Ca(NO₃)₂ ————- 164 g
x —————————————– 90 g
x = 0,548 mol de Ca(NO₃)₂
Se 90 g correspondem a 0,548 mol de Ca(NO₃)₂, a concentração molar é de 0,548 mol/L
O Ca(NO₃)₂ se dissocia completamente em água, formando íons cálcio (Ca²⁺) e íons nitrato (NO₃⁻). A equação da dissociação é:
Ca(NO3)2 (s) → Ca2+ (aq) + 2 NO3− (aq)
Cada mol de Ca(NO₃)₂ fornece 2 mol de NO₃⁻, então a concentração de NO₃⁻ é:
1 mol de Ca(NO₃)₂ ——————– 2 mol de NO₃⁻
0,548 mol/L de Ca(NO₃)₂ ——– y
y = 1,096 mol/L de íons nitrato.
Agora, precisamos calcular o volume da solução nutritiva necessário para atingir a concentração desejada de íons nitrato no tanque. A concentração inicial de íons nitrato na solução nutritiva é 1,096 mol/L, e o volume da solução nutritiva que queremos determinar é dado por .
O volume final será igual ao volume total do tanque, que é 5.000 L, e a concentração final desejada de íons nitrato no tanque é 0,009 mol/L. Para encontrar o volume da solução nutritiva a ser adicionado, utilizamos a fórmula da diluição por adição de solvente, partindo da ideia de que: ao diluir uma solução, a quantidade de soluto permanece constante, mas o volume da solução aumenta.
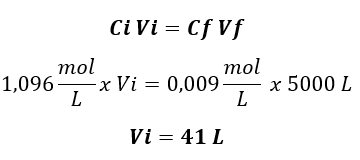
O volume de solução nutritiva que o produtor deve adicionar ao tanque para atingir uma concentração final de 0,009 mol/L de íons nitrato é de aproximadamente 41 litros.
Alternativa B






