Atualmente, soldados em campo, seja em treinamento ou em combate, podem aquecer suas refeições, prontas e embaladas em bolsas plásticas, utilizando aquecedores químicos, sem precisar fazer fogo. Dentro dessas bolsas existe magnésio metálico em pó e, quando o soldado quer aquecer a comida, ele coloca água dentro da bolsa, promovendo a reação descrita pela equação química:
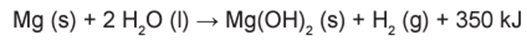
O aquecimento dentro da bolsa ocorre por causa da
A) redução sofrida pelo oxigênio, que é uma reação exotérmica.
B) oxidação sofrida pelo magnésio, que é uma reação exotérmica.
C) redução sofrida pelo magnésio, que é uma reação endotérmica.
D) oxidação sofrida pelo hidrogênio, que é uma reação exotérmica.
E) redução sofrida pelo hidrogênio, que é uma reação endotérmica.
Solução
O aquecimento dentro da bolsa resulta da oxidação do magnésio, uma reação exotérmica que libera uma quantidade significativa de calor, aproximadamente 350 kJ.
O caráter exotérmico da reação é evidenciado pela forma como a equação está escrita: os ‘350 kJ’ estão indicados ao lado dos produtos, indicando a liberação de calor. Além disso, a oxidação do magnésio pode ser observada pela mudança no número de oxidação (NOX). O magnésio metálico tem NOX 0 (Mg⁰), enquanto no Mg(OH)₂, o magnésio possui NOX +2, o que representa a perda de elétrons durante a reação.”
Alternativa B






