A minimização do tempo e custo de uma reação química, bem como o aumento na sua taxa de conversão, caracterizam a eficiência de um processo químico. Como consequência, produtos podem chegar ao consumidor mais baratos. Um dos parâmetros que mede a eficiência de uma reação química é o seu rendimento molar (R, em %), definido como
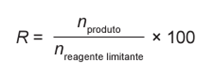
em que n corresponde ao número de mols. O metanol pode ser obtido pela reação entre brometo de metila e hidróxido de sódio, conforme a equação química:
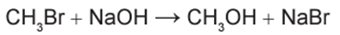
As massas molares (em g/mol) desses elementos são: H = 1; C = 12; O = 16; Na = 23; Br = 80.
O rendimento molar da reação, em que 32 g de metanol foram obtidos a partir de 142,5 g de brometo de metila e 80 g de hidróxido de sódio, é mais próximo de
A) 22%.
B) 40%.
C) 50%.
D) 67%.
E) 75%.
Solução
De acordo com a reação balanceada, 1 mol de brometo de metila (CH3Br) produz 1 mol de metanol (CH3OH). Com base nas massas molares envolvidas, 95 g de NaBr, assumindo um rendimento de 100%, devem gerar 32 g de CH3OH.
Portanto, se a massa de partida for igual a 142,5 g de NaBr, a massa de metanol produzida, com 100% de rendimento, será:
95 g de NaBr ————– 32 g de CH3OH
142,5 g de NaBr ———- x
x = 48 g de CH3OH
A massa teórica de metanol esperada é de 48 g, porém foram obtidos 32 g. O rendimento da reação, portanto, é:
48 g de CH3OH ———— 100%
32 g de CH3OH ———— y
Y = 66,6% (aproximadamente 67% de rendimento)
Alternativa D






