O polímero PET (tereftalato de polietileno), material presente em diversas embalagens descartáveis, pode levar centenas de anos para ser degradado e seu processo de reciclagem requer um grande aporte energético. Nesse contexto, uma técnica que visa baratear o processo foi implementada recentemente. Trata-se do aquecimento de uma mistura de plásticos em um reator, a 700 °C e 34 atm, que promove a quebra das ligações químicas entre átomos de hidrogênio e carbono na cadeia do polímero, produzindo gás hidrogênio e compostos de carbono que podem ser transformados em microesferas para serem usadas em tintas, lubrificantes, pneus, dentre outros produtos.
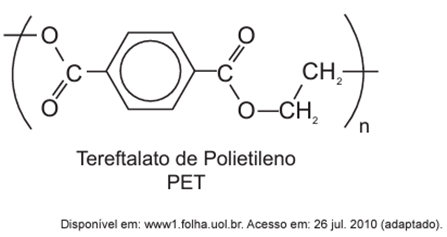
Considerando o processo de reciclagem do PET, para tratar 1 000 g desse polímero, com rendimento de 100%, o volume de gás hidrogênio liberado, nas condições apresentadas, encontra-se no intervalo entre
Dados: Constante dos gases R = 0,082 L atm/mol K; Massa molar do monômero do PET = 192 g/mol; Equação de estado dos gases ideais: PV = nRT
A) 0 e 20 litros.
B) 20 e 40 litros.
C) 40 e 60 litros.
D) 60 e 80 litros.
E) 80 e 100 litros.
Solução
A partir da equação de estado dos gases ideais (PV = nRT), podemos calcular o volume de gás hidrogênio liberado e descobrir em qual intervalo o valor se encontra.
Para isso, precisamos encontrar quantos mol de H2 são formados a partir do polímero em questão. No monômero do tereftalato de polietileno (C10H8O4) existem 8 átomos de hidrogênio, que é a fonte de todo H2 liberado. Sendo assim, podemos considerar, por um simples balanceamento, que cada mol do polímero deve gerar 4 mol de H2:
C10H8O4 → 4 H2 + compostos contendo carbono e oxigênio.
A partir de uma relação com a massa molar do PET (192 g/mol) é possível estabelecer uma relação para descobrir quantos mol de H2 serão formados ao serem tratados 1000 g do polímero:
MASSA DO POLÍMERO MOL DE H2
192 g —————————— 4 mol
1000 g —————————- x
x = 20,83 mol de H2
Considerando que a temperatura deve estar sempre em Kelvin, já temos todos os dados necessários para substituir na equação de estado dos gases ideais:
p = 34 atm
n = 20,83 mol
R = 0,082 L atm/mol K
T = 973 K (700 oC + 273)
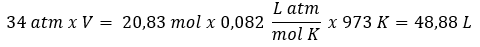
O volume encontrado está entre 40 e 60 L
OBS: para o cálculo, estamos considerando somente 1 unidade do tereftalato de polietileno (monômero).
Alternativa C






