Para comparar a eficiência de diferentes combustíveis, costuma-se determinar a quantidade de calor liberada na combustão por mol ou grama de combustível. O quadro mostra o valor de energia liberada na combustão completa de alguns combustíveis.
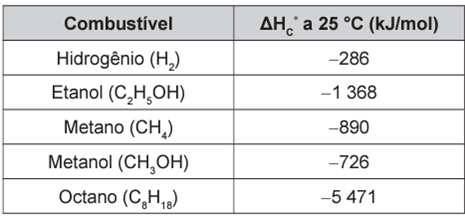
As massas molares dos elementos H, C e O são iguais a 1 g/mol, 12 g/mol e 16 g/mol, respectivamente.
ATKINS, P. Princípios de química. Porto Alegre: Bookman, 2007 (adaptado)
Qual combustível apresenta maior liberação de energia por grama?
A) Hidrogênio.
B) Etanol.
C) Metano.
D) Metanol.
E) Octano.
Solução
Vamos calcular a liberação de energia por grama de cada combustível:
Hidrogênio (H2):
Massa molar: 2 g/mol
2 g de H2 ———– 286 kJ de energia liberada
1 g de H2 ———– x
x = 143 kJ de energia por grama
Etanol (C2H5OH):
Massa molar: 46 g/mol
46 g de C2H5OH ———– 1 368 kJ de energia liberada
1 g de C2H5OH————- y
y = 29,73 kJ de energia por grama
Metano (CH4):
Massa molar: 16 g/mol
16 g de CH4 —————- 890 kJ de energia liberada
1 g de CH4 —————— z
z = 55,62 kJ de energia por grama
Metanol (CH3OH):
Massa molar: 32 g/mol
32 g de CH3OH —————- 726 kJ de energia liberada
1 g de CH3OH—————— w
w = 22,68 kJ de energia por grama
Octano (C8H18):
Massa molar: 114 g/mol
114 g de C8H18 —————- 5 471 kJ de energia liberada
1 g de C8H18 —————— k
w = 47,99 kJ de energia por grama
A partir dos cálculos, concluímos que o hidrogênio apresenta maior liberação de energia por grama (143 kJ liberados).
Alternativa A






