A composição média de uma bateria automotiva esgotada é de aproximadamente 32% Pb, 3% PbO, 17% PbO2 e 36% PbSO4. A média de massa da pasta residual de uma bateria usada é de 6 kg, onde 19% é PbO2 , 60% PbSO4 e 21% Pb. Entre todos os compostos de chumbo presentes na pasta, o que mais preocupa é o sulfato de chumbo (II), pois nos processos pirometalúrgicos, em que os compostos de chumbo (placas das baterias) são fundidos, há a conversão de sulfato em dióxido de enxofre, gás muito poluente. Para reduzir o problema das emissões de SO2(g), a indústria pode utilizar uma planta mista, ou seja, utilizar o processo hidrometalúrgico, para a dessulfuração antes da fusão do composto de chumbo. Nesse caso, a redução de sulfato presente no PbSO4 é feita via lixiviação com solução de carbonato de sódio(Na2CO3) 1M a 45 ºC, em que se obtém o carbonato de chumbo (II) com rendimento de 91%. Após esse processo, o material segue para a fundição para obter o chumbo metálico.
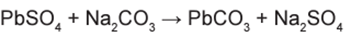
Dados: Massas Molares em g/mol Pb = 207; S = 32; Na = 23; O = 16; C = 12
ARAÚJO, R. V. V.; TINDADE, R. B. E.; SOARES, P. S. M. Reciclagem de chumbo de bateria automotiva:
estudo de caso. Disponível em: http://www.iqsc.usp.br. Acesso em: 17 abr. 2010 (adaptado).
Segundo as condições do processo apresentado para a obtenção de carbonato de chumbo (II) por meio da lixiviação por carbonato de sódio e considerando uma massa de pasta residual de uma bateria de 6 kg, qual quantidade aproximada, em quilogramas, de PbCO3 é obtida?
A) 1,7 kg
B) 1,9 kg
C) 2,9 kg
D) 3,3 kg
E) 3,6 kg
Solução
Primeiramente, devemos calcular a quantidade de PbSO4 na massa residual, que representa 60% do total. Considerando que a massa da pasta residual da bateria é de 6 kg, a massa de PbSO4 é:
6 kg (massa de pasta residual) ——— 100%
x (massa de PbSO4) ———————– 60%
x = 3,6 kg de PbSO4
Analisando a reação para a obtenção de PbCO3:
Podemos observar a seguinte relação:
– 303 g de PbSO4 (1 mol) produzem 267 g de PbCO3 (1 mol).
– Com 3,6 kg de PbSO4, a quantidade de PbCO3 produzida (assumindo um rendimento de 100%) é de:
303 g de PbSO4 ———— 267 g de PbCO3
3,6 kg de PbSO4 ———– y
y = 3,2 kg de PbCO3
Entretanto, como o rendimento do processo é de 91%, a massa real de PbCO3 obtida é de:
3,2 kg de PbCO3 ———— 100%
z ——————————– 91%
z = 2,91 kg de PbCO3
Alternativa C






