Para proteger estruturas de aço da corrosão, a indústria utiliza uma técnica chamada galvanização. Um metal bastante utilizado nesse processo é o zinco, que pode ser obtido a partir de um minério denominado esfalerita (ZnS), de pureza 75%. Considere que a conversão do minério em zinco metálico tem rendimento de 80% nesta sequência de equações químicas:
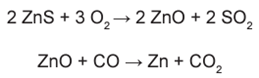
Considere as massas molares: ZnS (97 g/mol); O2 (32 g/mol); ZnO (81 g/mol); SO2 (64 g/mol); CO (28 g/mol); CO2 (44 g/mol); e Zn (65 g/mol).
Que valor mais próximo de massa de zinco metálico, em quilogramas, será produzido a partir de 100 kg de esfalerita?
A) 25
B) 33
C) 40
D) 50
E) 54
Solução
Para que a massa de zinco metálico, produzida a partir da esfarelita, seja calculada, é necessário do processo global:
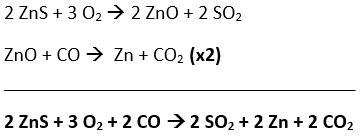
A esfarelita é o minério que contém ZnS e a sua pureza é de 75%. A partir de uma massa de 100 kg de esfarelita, a massa de ZnS capaz de reagir é:
100% ——— 100 kg de esfarelita
75% ———– x (massa somente de ZnS)
x = 75 kg de ZnS
Considerando que 2 mol de ZnS formam 2 mol de Zn, podemos estabelecer a seguinte relação:
2 mol de ZnS 2 mol de Zn
2 97 g —————— 2 65 g
75 g ———————– y
y = 50,25 kg de Zn
Caso o rendimento da reação fosse de 100%, a massa de Zn obtida seria de 50,25 kg. Porém, o rendimento é de 80%, logo:
50,25 kg ———— 100%
z ———————- 80%
z = 40,2 kg de Zn
Alternativa C






