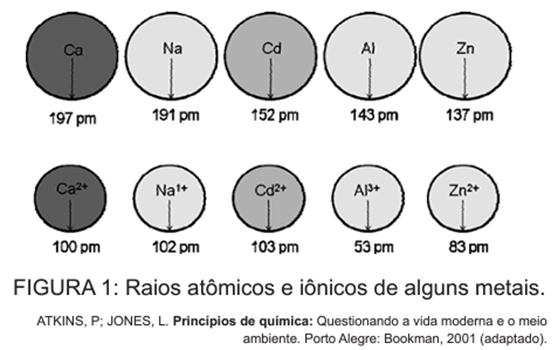
O cádmio, presente nas baterias, pode chegar ao solo quando esses materiais são descartados de maneira irregular no meio ambiente ou quando são incinerados. Diferentemente da forma metálica, os íons Cd2+ são extremamente perigosos para o organismo, pois eles podem substituir íons Ca2+, ocasionando uma doença degenerativa nos ossos, tornando-os muito porosos e causando dores intensas nas articulações. Podem ainda inibir enzimas ativadas pelo cátion Zn2+, que são extremamente importantes para o funcionamento dos rins. A figura mostra a variação do raio de alguns metais e seus respectivos cátions.
Com base no texto, a toxicidade do cádmio em sua forma iônica é consequência de esse elemento
A) apresentar baixa energia de ionização, o que favorece a formação do íon e facilita sua ligação a outros compostos.
B) possuir tendência de atuar em processos biológicos mediados por cátions metálicos com cargas que variam de +1 a +3.
C) possuir raio e carga relativamente próximos aos de íons metálicos que atuam nos processos biológicos, causando interferência nesses processos.
D) apresentar raio iônico grande, permitindo que ele cause interferência nos processos biológicos em que, normalmente, íons menores participam.
E) apresentar carga +2, o que permite que ele cause interferência nos processos biológicos em que, normalmente, íons com cargas menores participam.
Solução
A partir da análise da figura fornecida, é notável que o raio do íon Ca²⁺ (100 pm) é bastante próximo ao raio do íon Cd²⁺ (103 pm), e ambos possuem cargas idênticas (+3). A toxicidade do cádmio em sua forma iônica pode ser atribuída, portanto, ao fato de que seu raio e carga são muito semelhantes aos dos íons metálicos que desempenham papéis importantes em processos biológicos. Essa semelhança permite que o cádmio interfira nesses processos, substituindo os íons essenciais e causando efeitos indesejados.
Alternativa C






