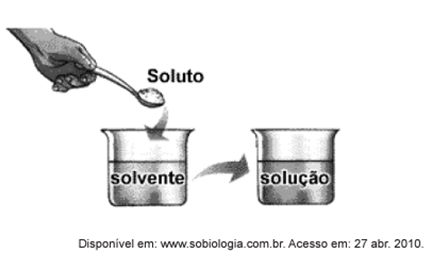
Ao colocar um pouco de açúcar na água e mexer até a obtenção de uma só fase, prepara-se uma solução. O mesmo acontece ao se adicionar um pouquinho de sal à água e misturar bem. Uma substância capaz de dissolver o soluto é denominada solvente; por exemplo, a água é um solvente para o açúcar, para o sal e para várias outras substâncias. A figura a seguir ilustra essa citação.
Suponha que uma pessoa, para adoçar seu cafezinho, tenha utilizado 3,42 g de sacarose (massa molar igual a 342 g/mol) para uma xícara de 50 mℓ do líquido. Qual é a concentração final, em mol/ℓ, de sacarose nesse cafezinho?
A) 0,02
B) 0,2
C) 2
D) 200
E) 2000
Solução
1 mol de sacarose tem uma massa molar de 342 g/mol. Para calcular a quantidade em mol de 3,42 g de sacarose, podemos estabelecer a seguinte relação:
342 g de sacarose ——— 1 mol
3,42 g de sacarose ——— x
x = 0,01 mol de sacarose.
A concentração em mol/L é calculada dividindo o número de mol pelo volume (que no caso é de 50 mL)
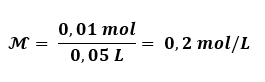
Alternativa B






