O flúor é usado de forma ampla na prevenção de cáries. Por reagir com a hidroxiapatita [Ca₁₀(PO₄)₆(OH)₂ ] presente nos esmaltes dos dentes, o flúor forma a fluorapatita [Ca₁₀(PO₄)₆F₂], um mineral mais resistente ao ataque ácido decorrente da ação de bactérias específicas presentes nos açúcares das placas que aderem aos dentes.
Disponível em: http://www.odontologia.com.br. Acesso em: 27 jul. 2010 (adaptado).
A reação de dissolução da hidroxiapatita é:
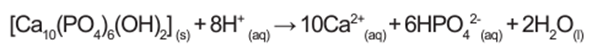
Dados: Massas molares em g/mol — [Ca10(PO4)6(OH2)] = 1004; HPO42- = 96; Ca = 40.
Supondo-se que o esmalte dentário seja constituído exclusivamente por hidroxiapatita, o ataque ácido que dissolve completamente 1 mg desse material ocasiona a formação de, aproximadamente,
A) 0,14 mg de íons totais.
B) 0,40 mg de íons totais.
C) 0,58 mg de íons totais.
D) 0,97 mg de íons totais.
E) 1,01 mg de íons totais.
Solução
Pela estequiometria da reação de dissolução, 1 mol de[Ca10(PO4)6(OH2)] forma 16 mol de íons totais (10 mol de Ca2+ e 6 mol de HPO42-). Em função das massas, podemos estabelecer a seguinte relação:
1 mol de [Ca10(PO4)6(OH2)] = 1004 g
10 mol de Ca2+ = 400 g (40 g/mol x 10 mol)
6 mol de HPO42- = 576 g (96 g/mol x 6)
Sendo assim:
1004 g de [Ca10(PO4)6(OH2)] ————- 976 g de íons totais
1 mg de [Ca10(PO4)6(OH2)] —————— x
x = 0,97 mg de íons totais
Alternativa D






