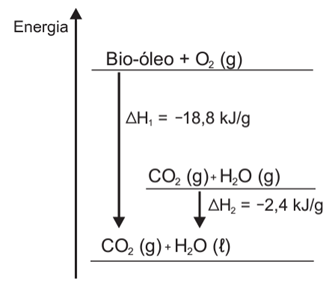
O aproveitamento de resíduos florestais vem se tornando cada dia mais atrativo, pois eles são uma fonte renovável de energia. A figura representa a queima de um bio-óleo extraído do resíduo de madeira, sendo ∆H1 a variação de entalpia devido à queima de 1 g desse bio-óleo, resultando em gás carbônico e água líquida, e ∆H2 a variação de entalpia envolvida na conversão de 1 g de água no estado gasoso para o estado líquido.
A variação de entalpia, em kJ, para a queima de 5 g desse bio-óleo resultando em CO2 (gasoso) e H2 O (gasoso) é:
A) -106.
B) -94,0.
C) -82,0.
D) -21,2.
E) -16,4.
Solução
No gráfico, a queima do bio-óleo, que produz CO₂ (g) e H₂O (l), é representada pela variação de entalpia ΔH₁, que é igual a –18,8 kJ/g. Assim, para a queima de 5 g de bio-óleo, a variação total de entalpia será:
1 g ———— 18,8 kJ de energia liberada
5 g ———— x
x = 94,0 kJ de energia liberada.
Mas para se obter a água no estado gasoso, devemos considerar o processo inverso do indicado pelo ΔH₂. Portanto, a variação de entalpia para converter água do estado líquido para o gasoso é +2,4 kJ/g. Assim, para 5 g de bio-óleo queimado, a variação total de entalpia será:
1 g ———— 2,4 kJ de energia absorvida
5 g ———— y
y = 12,0 kJ de energia absorvida.
Somando os dois processos, obtemos: –94,0 kJ + 12,0 kJ = –82,0 kJ.
Alternativa C






