Grandes fontes de emissão do gás dióxido de enxofre são as indústrias de extração de cobre e níquel, em decorrência da oxidação dos minérios sulfurados. Para evitar a liberação desses óxidos na atmosfera e a consequente formação da chuva ácida, o gás pode ser lavado, em um processo conhecido como dessulfurização, conforme mostrado na equação (1).

Por sua vez, o sulfito de cálcio formado pode ser oxidado, com o auxílio do ar atmosférico, para a obtenção do sulfato de cálcio, como mostrado na equação (2). Essa etapa é de grande interesse porque o produto da reação, popularmente conhecido como gesso, é utilizado para fins agrícolas.
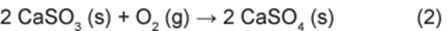
As massas molares dos elementos carbono, oxigênio, enxofre e cálcio são iguais a 12 g/mol, 16 g/mol, 32 g/mol e 40 g/mol, respectivamente.
BAIRD, C. Química ambiental. Porto Alegre: Bookman, 2002 (adaptado).
Considerando um rendimento de 90% no processo, a massa de gesso obtida, em gramas, por mol de gás retido é mais próxima de
A) 64.
B) 108.
C) 122.
D) 136.
E) 245.
Solução
Primeiramente, precisamos obter o processo global a partir das duas etapas fornecidas:
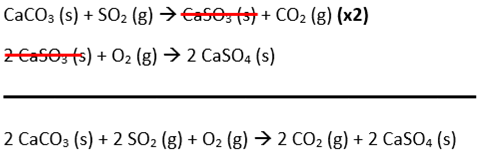
A partir da equação global balanceada, a massa de gesso (CaSO4) obtida para cada 1 mol de gás (SO2) retido, é dada por:
– 2 mol de SO2 formam 2 mol de CaSO4. Logo, 1 mol do gás formará 1 mol de CaSO4. 1 mol de CaSO4 possui massa de 136 g. Considerando que o processo rende 90%, temos:
136 g ———— 100%
90 g ————– x
x = 122,4 g de CaSO4
Alternativa C






