A escolha de uma determinada substância para ser utilizada como combustível passa pela análise da poluição que ela causa ao ambiente e pela quantidade de energia liberada em sua combustão completa. O quadro apresenta a entalpia de combustão de algumas substâncias. As massas molares dos elementos H, C e O são, respectivamente, iguais a 1 g/mol, 12 g/mol e 16 g/mol.
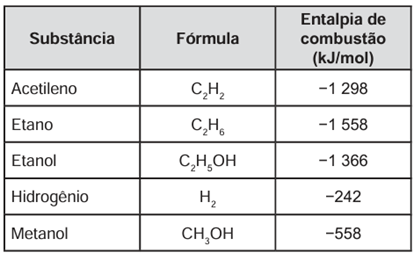
Levando-se em conta somente o aspecto energético, a substância mais eficiente para a obtenção de energia, na combustão de 1 kg de combustível, é o
A) etano.
B) etanol.
C) metanol.
D) acetileno.
E) hidrogênio.
Solução
A substância mais eficiente para obtenção de energia é aquela que libera mais calor durante a combustão. Considerando 1 kg (1000 g) como a massa de cada uma das substâncias, temos:
Acetileno → 26 g/mol
26 g ———– 1 298 kJ
1000 g ——– x
x = 49.923 kJ de energia liberada, aproximadamente
Etano → 30 g/mol
30 g ———– 1 558 kJ
1000 g ——– y
y = 51.933 kJ de energia liberada, aproximadamente
Etanol → 46 g/mol
46 g ———– 1 366 kJ
1000 g ——– w
w = 29.695,65 kJ de energia liberada, aproximadamente
Hidrogênio → 2 g/mol
2 g ———– 242 kJ
1000 g ——– z
z = 121.000 kJ de energia liberada
Metanol → 32 g/mol
32 g ———– 558 kJ
1000 g ——– k
k = 17.437 kJ de energia liberada, aproximadamente
A substância mais eficiente é o hidrogênio.
Alternativa E






