Em 1938 o arqueólogo alemão Wilhelm König, diretor do Museu Nacional do Iraque, encontrou um objeto estranho na coleção da instituição, que poderia ter sido usado como uma pilha, similar às utilizadas em nossos dias. A suposta pilha, datada de cerca de 200 a.C., é constituída de um pequeno vaso de barro (argila) no qual foram instalados um tubo de cobre, uma barra de ferro (aparentemente corroída por ácido) e uma tampa de betume (asfalto), conforme ilustrado. Considere os potenciais-padrão de redução: E° (Fe2+|Fe) = -0,44 V; E° (H+|H2) = -0,00 V; e E° (Cu2+|Cu) = +0,34 V.
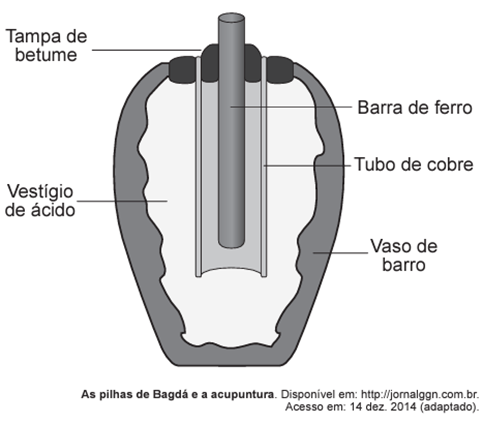
Nessa suposta pilha, qual dos componentes atuaria como cátodo?
A) A tampa de betume.
B) O vestígio de ácido.
C) A barra de ferro.
D) O tubo de cobre.
E) O vaso de barro.
Solução
Pilhas são dispositivos que utilizam uma reação química espontânea de oxirredução para geração de energia elétrica. A reação ocorre entre duas espécies com potenciais de redução diferentes, no qual a espécie de maior potencial tende a reduzir enquanto a de menor potencial tende a oxidar. Essas reações acontecem em compartimentos separados chamados, contendo um eletrodo: no ânodo sempre ocorrem reações de oxidação e no cátodo as reações de redução.
Pelo enunciado, sabemos que a barra de ferro foi corroída (oxidada), pois seu potencial de redução é o menor entre as três espécies envolvidas. Portanto, a barra de ferro constitui o ânodo da pilha.
A espécie que sofre a redução pode ser o íon H+ ou o Cu2+. Embora o íon Cu2+ tenha um potencial de redução mais alto, o enunciado não menciona a presença de íons de cobre no sistema, portanto não há como ocorrer a redução desse íon (já que todo o cobre do sistema está na forma metálica, ou seja, já reduzida). Assim, a única espécie presente na forma oxidada e capaz de sofrer redução é o íon H+. Assim, temos que:
Semirreação de Oxidação:
𝐹𝑒 → 𝐹𝑒2+ + 2𝑒− E = +0,44 V
Semirreação de Redução:
2𝐻+ + 2𝑒− →𝐻2 E = 0,0 V
Reação Global:
𝐹𝑒 + 2𝐻+ → 𝐹𝑒2+ + 𝐻2 ΔE = + 0,44 V
Podemos concluir que gás hidrogênio foi formado, o que explica o motivo de serem encontrados apenas vestígios de ácido no sistema, indicando que o ácido foi consumido e o gás foi liberado.
Portanto, o cátodo da pilha mencionada é composto pelo “tubo de cobre”, que serve como condutor dos elétrons para reduzir o íon H+.
Alternativa D






