A eletrólise é um processo não espontâneo de grande importância para a indústria química. Uma de suas aplicações é a obtenção do gás cloro e do hidróxido de sódio, a partir de uma solução aquosa de cloreto de sódio. Nesse procedimento, utiliza-se uma célula eletroquímica, como ilustrado.
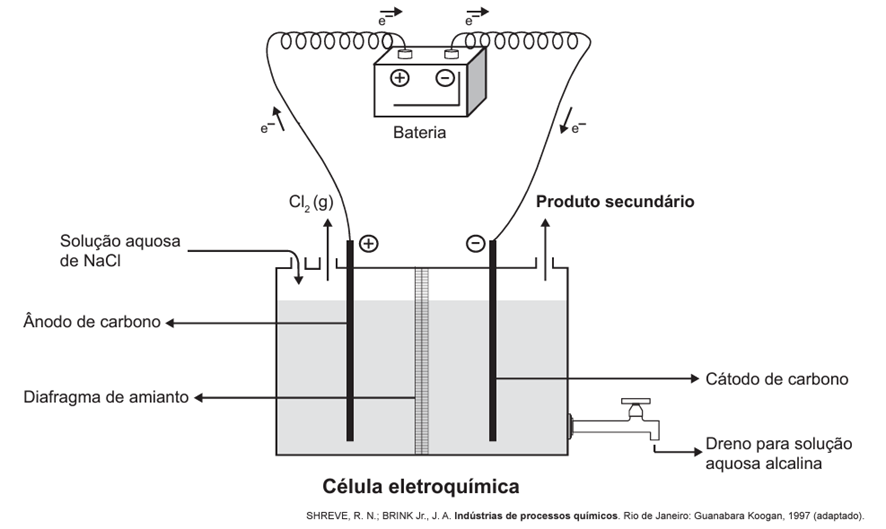
No processo eletrolítico ilustrado, o produto secundário obtido é o
A) vapor de água.
B) oxigênio molecular.
C) hipoclorito de sódio.
D) hidrogênio molecular.
E) cloreto de hidrogênio.
Solução
A eletrólise aquosa do NaCl (cloreto de sódio) consiste na decomposição de uma solução de NaCl através da passagem de uma corrente elétrica. Na solução, estão presentes os íons Na⁺ e Cl⁻ do sal, bem como os íons H⁺ e OH⁻ provenientes da água. No processo, os cátions Na⁺ e H⁺ competem entre si, e apenas um será reduzido. Da mesma forma, os ânions Cl⁻ e OH⁻ competem para serem oxidados.
O íon H⁺ tem uma maior tendência a ser reduzido, enquanto o íon Cl⁻ tem uma maior tendência a ser oxidado. Como resultado, os produtos principais da eletrólise aquosa de NaCl são o hidrogênio gasoso (H₂) no cátodo e o cloro gasoso (Cl₂) no ânodo. Além disso, o hidróxido de sódio (NaOH) é formado como um subproduto, o que torna o meio alcalino, conforme indicado na figura apresentada.
Resumidamente, o hidrogênio gasoso (H₂) é produzido no cátodo, polo negativo durante a eletrólise, onde ocorre a redução do cátion com a maior tendência de ser reduzido. Como o sódio se mantém na forma iônica e o íon OH⁻ está presente em solução, o hidróxido de sódio (NaOH) é formado como um produto secundário, tornando o meio alcalino.
Alternativa D






