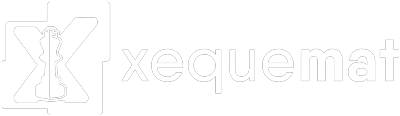A presença de substâncias ricas em enxofre em áreas de mineração provoca preocupantes impactos ambientais. Um exemplo dessas substâncias é a pirita (FeS2), que, em contato com o oxigênio atmosférico, reage formando uma solução aquosa ferruginosa, conhecida como drenagem ácida de minas, segundo a equação química:

Em situações críticas, nas quais a concentração do ácido sulfúrico atinge 9,8 g/L, o pH alcança valores menores que 1,0. Uma forma de reduzir o impacto da drenagem ácida de minas é tratá-la com calcário (CaCO3). Considere que uma amostra comercial de calcário, com pureza igual a 50% em massa, foi disponibilizada para o tratamento.
FIGUEIREDO, B. R. Minérios e ambientes. Campinas: Unicamp, 2000 (adaptado).
Qual é a massa de calcário, em gramas, necessária para neutralizar um litro de drenagem ácida de minas, em seu estado crítico, sabendo-se que as massas molares do CaCO3 e do H2SO4 são iguais a 100 g/mol e 98 g/mol, respectivamente?
A) 0,2
B) 5,0
C) 10,0
D) 20,0
E) 200,0
Solução
Para neutralizar a drenagem ácida de minas, que contém ácido sulfúrico (H2SO4), precisamos calcular a quantidade necessária de calcário (que contém CaCO3). Pela estequiometria da reação química balanceada, temos que 1 mol de calcário é capaz de neutralizar 1 mol de ácido:
CaCO3 + H2SO4 → CaSO4 + CO2 + H2O
A concentração do ácido sulfúrico na drenagem ácida é 9,89 g/L, o que significa que a cada 1 L de drenagem ácida existem 9,8 g do ácido. Considerando a massa de 1 mol do H2SO4 igual a 98 g e a do calcário 100g, temos que:
MASSA H2SO4 MASSA CaCO3
98 g ———————- 100 g
9,8 g ———————- x
x = 10,0 g de CaCO3 (massa necessária para neutralizar 9,8 g de ácido)
Porém, quando se menciona que o calcário possui uma pureza de 50% em massa, isso significa que a amostra comercial de calcário é composta por 50% de CaCO3 e os outros 50% são de outros componentes que não contribuem para a neutralização. Portanto, se precisamos de 10,0 gramas de CaCO3 puro para neutralizar a drenagem ácida, precisamos considerar a pureza do calcário.
Para calcular a quantidade de calcário necessária para obter os 10,0 gramas de CaCO3 puro, usamos a seguinte relação:
MASSA PORCENTAGEM
10 g de CaCO3 —— 50%
y g de calcário —— 100%
y = 20,0 g de calcário (em 20,0 g de calcário existem 10,0 g de CaCO3)
Alternativa D