O sulfato de bário (BaSO4) é mundialmente utilizado na forma de suspensão como contraste em radiografias de esôfago, estômago e intestino. Por se tratar de um sal pouco solúvel, quando em meio aquoso estabelece o seguinte equilíbrio:
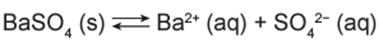
Por causa da toxicidade do bário (Ba2+), é desejado que o contraste não seja absorvido, sendo totalmente eliminado nas fezes. A eventual absorção de íons Ba2+, porém, pode levar a reações adversas ainda nas primeiras horas após sua administração, como vômito, cólicas, diarreia, tremores, crises convulsivas e até mesmo a morte.
PEREIRA, L. F. Entenda o caso da intoxicação por Celobar®.
Disponível em: www.unifesp.br. Acesso em: 20 nov. 2013 (adaptado).
Para garantir a segurança do paciente que fizer uso do contraste, deve-se preparar essa suspensão em
A) água destilada.
B) soro fisiológico.
C) solução de cloreto de bário, BaCl2.
D) solução de sulfato de bário, BaSO4.
E) solução de sulfato de potássio, K2SO4.
Solução
Íons Ba²⁺ em altas concentrações podem ser tóxicos para o organismo. Para reduzir esse risco, é importante deslocar o equilíbrio químico para favorecer a formação de sal de bário (BaSO₄), que é pouco solúvel. Tal deslocamento reduz a disponibilidade de íons Ba²⁺ em solução.
Portanto, o objetivo é fazer com que o equilíbrio químico se desloque na direção da formação do sal de bário. Para isso, é necessário recomendado preparar a suspensão em sulfato de potássio (K₂SO₄). O aumento da concentração de íons sulfato (SO₄²⁻) em solução, de acordo com o princípio de Le Chatelier, favorece o equilíbrio no sentido de formação do BaSO₄, pois consome os íons SO₄²⁻ e, consequentemente, reduz a quantidade de íons Ba²⁺ na solução.
Alternativa E






