O cobre presente nos fios elétricos e instrumentos musicais é obtido a partir da ustulação do minério calcosita (Cu2S). Durante esse processo, ocorre o aquecimento desse sulfeto na presença de oxigênio, de forma que o cobre fique “livre” e o enxofre se combine com o O2 produzindo SO2, conforme a equação química:
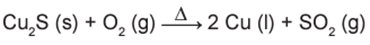
As massas molares dos elementos Cu e S são, respectivamente, iguais a 63,5 g/mol e 32 g/mol.
CANTO, E. L. Minerais, minérios, metais: de onde vêm?, para onde vão?
São Paulo: Moderna, 1996 (adaptado).
Considerando que se queira obter 16 mols do metal em uma reação cujo rendimento é de 80%, a massa, em gramas, do minério necessária para obtenção do cobre é igual a
A) 955.
B) 1 018.
C) 1 590.
D) 2 035.
E) 3 180.
Solução
Pela estequiometria da reação, 1 mol de Cu2S (159 g/mol) forma 2 mol de Cu. Portanto, a massa do reagente necessária para que sejam formados 16 mol do metal é dada por:
159 g de Cu2S ———- 2 mol de Cu
x —————————— 16 mol
x = 1272 g de Cu2S formam exatamente 16 mol do metal em uma reação com 100% de conversão dos reagentes em produtos.
Porém, de acordo com a informação do enunciado, a reação em questão rende 80%. Isso significa, portanto, que é necessário colocar uma massa de partida maior do que 1272 g, para que quando o rendimento for considerado, o resultado seja conforme o esperado.
1272 g de Cu2S ——- 80%
y —————————– 100%
y = 1590 g de Cu2S
A massa de 1590 g do reagente fornecerá, ao final do processo que rende 80%, os 16 mol do cobre em sua forma metálica.
Alternativa C






